Câu hỏi 1 :
Cho 2,7 gam hỗn hợp bột X gồm Fe và Zn tác dụng với dung dịch CuSO4. Sau mọt thời gian, thu được dung dịch Y và 2,84 gam chất rắn Z. Cho toàn bộ Z vào dung dịch H2SO4 loãng dư. Sau khi các phản ứng kết thúc thì khối lượng chất rắn giảm 0,28 gam và dung dịch thu được chỉ chứa một muối duy nhất. Phần trăm khối lượng của Fe trong X là
- A 58,52%
- B 51,85%
- C 48,15%
- D 41,48%
Đáp án: B
Phương pháp giải:
- Vì Z có khối lượng lớn hơn X nên Zn phản ứng hết, Fe phản ứng một phần
- Gọi số mol Zn và Fe phản ứng lần lượt là a và b
- Biểu diễn khối lượng hỗn hợp X (1)
- Biểu diễn khối lượng hỗn hợp Z (2)
- Giải ra a, b
- Tính %mFe
Lời giải chi tiết:
Vì mZ > mX nên Zn phản ứng hết, Fe phản ứng một phần
Đặt a, b là số mol Zn và Fe đã phản ứng.
Ta có: mX = 65a + 56b + 0,28 = 2,7
Và mZ = 64(a + b) + 0,28 = 2,84
→ a = b = 0,02
\( \to \% {m_{F{\rm{e}}}} = \frac{{56b + 0,28}}{{{m_X}}}.100\% = 51,85\% \)
Đáp án B
Câu hỏi 2 :
Hòa tan hoàn toàn 14,5 gam hỗn hợp gồm Mg, Fe, Zn bằng dung dịch HCl dư, sau phản ứng thu được 6,72 lít khí (đktc). Khối lượng muối clorua thu được sau phản ứng là
- A
15,57 gam
- B
35,80 gam
- C
25,15 gam
- D
16,63 gam
Đáp án: B
Phương pháp giải:
- Tính số mol gốc Cl- theo số mol H2
- Áp dụng bảo toàn khhối lượng cho muối clorua, tinh khối lượng muối.
Lời giải chi tiết:
\({n_{C{l^ - }}} = 2{n_{{H_2}}} = 0,6\,\,mol\)
\( \to {m_{muoi}} = {m_{KL}} + {m_{C{l^ - }}} = 35,8\,\,gam\)
Đáp án B
Câu hỏi 3 :
Cho 2,8g bột Fe và 2,7 g bột Al vào dung dịch có 0,175 mol Ag2SO4. Khi phản ứng xong thu được m gam hỗn hợp 2 kim loại. Giá trị của m là:
- A 32,4 g.
- B 34,2g.
- C 5,6g.
- D 39,2g
Đáp án: D
Phương pháp giải:
2 kim loại tác dụng với 1 dd muối thì kim loại mạnh sẽ phản ứng trước, khi nào hết mới đến kim loại yếu hơn.
Đề bài cho thu được hh 2 kim loại sau phản ứng → gồm Ag và Fe dư
Vậy Al, Ag2SO4 pư hết, Fe phản ứng 1 phần
Lời giải chi tiết:
nFe = 2,8 : 56 = 0,05 (mol)
nAl = 2,7 : 27 = 0,1 (mol)
Sau phản ứng thu được 2 kim loại → 2 kim loại gồm: Ag và Fe dư. Vậy Al và Ag2SO4 pư hết. Phản ứng xảy ra theo thứ tự sau:
2Al + 3Ag2SO4 → Al2(SO4)3 + 6Ag↓
(mol) 0,1 → 0,15 → 0,3
Còn 0,025
Fe + Ag2SO4 → FeSO4 + 2Ag↓
(mol)0,025 ← 0,025 → 0,05
Vậy sau phản ứng thu được: Ag: 0,3 + 0,05 = 0,35 (mol) và Fe dư: 0,05 – 0,025 = 0,025 (mol)
→ m = 0,35.108 + 0,025.56 = 39,2 (g)
Đáp án D
Câu hỏi 4 :
Cho 2,52 g một kim loại tác dụng với dung dịch H2SO4 loãng tạo ra 6,84 g muối sunfat. Kim loại đó là
- A
Mg.
- B Fe.
- C Al.
- D Zn.
Đáp án: B
Phương pháp giải:
- Viết phương trình hóa học
- Tính toán theo PTHH
Lời giải chi tiết:
Gọi kim loại là M
\(n_M=\dfrac{{2.52}}{{M}}\)
\(n_{{muoi}}=\dfrac{{6,84}}{{2M+96x}}\)
\(2M+xH_2SO_4 \to M_2(SO_4)_x +xH_2\)
Ta có \(n_M=2n_{{muoi}}\)
→ \(\dfrac{{2.52}}{{M}}=\dfrac{{2\times6,84}}{{2M+96x}}\)
→ M = 28.x
Vì M là kim loại nên x có giá trị 1, 2, 3
+ Nếu x = 1 → M = 28 (loại)
+ Nếu x = 2 → M = 56 (Fe)
+ Nếu x = 3 → M = 84 (loại)
Đáp án B
Câu hỏi 5 :
Cho hỗn hợp Fe và Zn tác dụng với dung dịch hỗn hợp chứa 0,01 mol HCl và 0,05 mol H2SO4. Sau phản ứng thu được chất rắn X, dung dịch Y và khí Z. Cho khí Z đi qua CuO dư, đun nóng thu được m gam Cu. Giá trị của m là
- A
5,32.
- B
3,52.
- C
2,35.
- D
2,53.
Đáp án: B
Phương pháp giải:
- Sau phản ứng thu được chất rắn → axit phản ứng hết
- BTNT "H" → số mol hiđro → số mol Cu
Lời giải chi tiết:
Sau phản ứng thu được chất rắn → axit phản ứng hết
BTNT "H" \(n_{H^+}=n_{HCl}+2n_{H_2SO_4}=2n_{H_2}=0,01+2\times0,05=0.11mol\)
→ \(n_{H_2}=0,055mol\)
\( CuO +H_2 \to Cu + H_2O\)
\(n_{Cu}=n_{H_2}=0,055mol\)
→ \(m_{Cu}=3,52g\)
Đáp án B
Câu hỏi 6 :
Cho 6 g hợp kim Cu, Fe và Al vào dung dịch axit HCl dư thấy thoát ra 3,024 lít H2 (đktc) và 1,86 g chất rắn không tan. Thành phần phần trăm của hợp kim là
- A
40% Fe, 28% Al, 32% Cu.
- B
41% Fe, 29% Al, 30% Cu.
- C
42% Fe, 27% Al, 31% Cu.
- D
43% Fe, 26% Al, 31% Cu.
Đáp án: C
Phương pháp giải:
- Chất rắn không tan là Cu
- Viết phương trình hóa học Fe và Al tác dụng HCl
- Lập hệ phương trình tính số mol Fe và Al
- Tính khối lượng và % từng chất
Lời giải chi tiết:
Chất rắn không tan là Cu → \(m _{Fe+Zn}=6-1,86=4,14g\)
Gọi số mol Fe, Al là x, y
\(Fe+2HCl \to FeCl_2+H_2\)
x → x\(2Al+6HCl \to 2AlCl_3+3H_2\)
y → 3/2 y
Ta có hệ x + 3/2 y = 0,135 (1); 56x + 27y = 4,14
→ x = 0,045; y = 0,06
→ \(m_{Fe}=2,52g; \; m_{Al}=1,62g\)
\(\% {m_{Fe}} = \frac{{2,52}}{6} \times 100\% = 42\% \)
\(\% {m_{Al}} = \frac{{1,62}}{6} \times 100\% = 27\% \)
\(\% {m_{Cu}} = 100\% - 42\% - 27\% = 31\% \)
Đáp án C
Câu hỏi 7 :
Nhúng một lá Mg vào dung dịch chứa 2 muối FeCl3 và FeCl2. Sau một thời gian lấy lá Mg ra làm khô rồi cân lại thấy khối lượng giảm so với ban đầu. Dung dịch sau thí nghiệm có cation nào sau đây ?
- A Mg2+.
- B
Mg2+ và Fe2+.
- C Mg2+, Fe2+ và Fe3+.
- D
Mg2+ hoặc Mg2+, Fe2+ và Fe3+.
Đáp án: C
Phương pháp giải:
Xác định phản ứng xảy ra trước.
Lời giải chi tiết:
Mg phản ứng với Fe3+ tạo Mg2+ → khối lượng thanh Mg giảm
Đáp án C
Câu hỏi 8 :
Ngâm một lá kim loại có khối lượng 50 gam trong dung dịch HCl, sau khi thu được 336 ml H2 (đktc) thì khối lượng lá kim loại giảm 1,68%. Xác định kim loại đã dùng.
- A Fe
- B Mg
- C Zn
- D Al
Đáp án: A
Phương pháp giải:
- Khối kim loại giảm là khối lượng kim loại phản ứng
- Gọi kim loại cần tìm là M có hóa trị x
- Số mol kim loại theo số mol hiđro → phương trình giữa M và x → Lập bảng tìm M và x.
Lời giải chi tiết:
Khối lượng kim loại giảm bằng khối lượng kim loại đã phản ứng bằng: 50.0,0168 = 0,84 (gam)
Đặt kim loại là M (hoá trị n), ta có PTHH:
2M + 2nH+ → 2Mn+ + nH2
\(\dfrac{{0,03}}{n}\) ← 0,015 (mol)
\(\to {M_M} = \dfrac{{0,84}}{ {0,03}}n = 28n\)
Lập bảng biện luận:
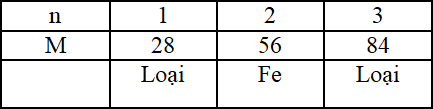
Đáp án A
Câu hỏi 9 :
Cho 5 gam hỗn hợp X gồm Ag và Al vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 3,36 lít khí (đktc). Phần trăm khối lượng Ag trong X là
- A 46%
- B 50,2%
- C 54,0%
- D 49,8%
Đáp án: A
Phương pháp giải:
- Khi cho hỗn hợp Ag và Al vào HCl dư thì chỉ có Al phản ứng:
- Viết và tính theo PTHH: 2Al + 6HCl → 2AlCl3 + 3H2
Lời giải chi tiết:
\({n_{{H_2}}} = \frac{{3,36}}{{22,4}} = 0,15(mol)\)
Khi cho hỗn hợp Ag và Al vào HCl dư thì chỉ có Al phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2
0,1 ← 0,15 (mol)
→ mAl = 0,1.27 = 2,7 gam
→ mAg = 5 - 2,7 = 2,3 gam
\( \to \% {m_{Ag}} = \frac{{2,3}}{5}.100\% = 46\% \)
Đáp án A
Câu hỏi 10 :
Hòa tan hết 3,53 gam hỗn hợp X gồm ba kim loại Mg, Al và Fe trong dung dịch HCl thu được 2,352 lít khí hiđro (đktc) và dung dịch Y. Cô cạn dung dịch Y, thu được m gam hỗn hợp muối khan. Giá trị của m là
- A 11,195.
- B 12,405.
- C 7,2575.
- D 10,985.
Đáp án: D
Phương pháp giải:
- Tổng quát: Kim loại + HCl → Muối + H2
- Bảo toàn nguyên tố H → \({n_{HCl}} = 2{n_{{H_2}}}\)
Bảo toàn khối lượng → \({m_{muoi}} = {m_X} + {m_{HCl}} - {m_{{H_2}}}\)
Lời giải chi tiết:
\({n_{{H_2}}} = \frac{{2,352}}{{22,4}} = 0,105(mol)\)
Tổng quát: Kim loại + HCl → Muối + H2
Bảo toàn nguyên tố H → \({n_{HCl}} = 2{n_{{H_2}}} = 2.0,105 = 0,21(mol)\)
Bảo toàn khối lượng → \({m_{muoi}} = {m_X} + {m_{HCl}} - {m_{{H_2}}} = 3,53 + 0,21.36,5 - 0,105.2 = 10,985(g)\)
Đáp án D
Câu hỏi 11 :
Hòa tan hoàn toàn 5,95 gam hỗn hợp hai kim loại Al và Zn bằng dung dịch H2SO4 loãng thì khối lượng dung dịch tăng 5,55 gam. Khối lượng Al và Zn (tính theo gam) trong hỗn hợp lần lượt là
- A 4,05 và 1,9.
- B 3,95 và 2,0.
- C 2,7 và 3,25.
- D 2,95 và 3,0.
Đáp án: C
Phương pháp giải:
Khối lượng dung dịch tăng là mdd tăng = mkim loại - mH2, từ đó tính được khối lượng H2.
Lập hệ phương trình về khối lượng hỗn hợp kim loại và khối lượng H2 để tính số mol mỗi kim loại trong hỗn hợp.
Lời giải chi tiết:
Khối lượng dung dịch tăng là mdd tăng = mkim loại - mH2 → mH2 =5,95 - 5,55 = 0,4 (g) → nH2 = 0,2 mol
Đặt số mol Al là x mol; số mol Zn là y mol. Ta có: mhh = 27x + 65y = 5,95 (g) (1)
2Al + 3H2SO4 →Al2(SO4)3 + 3H2
Zn + H2SO4 → ZnSO4 + H2
Ta có: nH2 = 1,5nAl + nZn = 1,5x + y = 0,2 (mol) (2)
Giải hệ (1) và (2) ta có: x = 0,1 và y = 0,05
Vậy mAl = 0,1.27 = 2,7 gam và mZn = 0,05.65 = 3,25 (g)
Đáp án C
Câu hỏi 12 :
Cho m (gam) hỗn hợp Al, Mg tác dụng với dung dịch HCl dư thu được 12,32 lít khí (đktc). Mặt khác, cũng m (gam) hỗn hợp trên cho tác dụng với dung dịch NaOH dư thu được 6,72 lít khí (đktc). Tính giá trị của m?
Phương pháp giải:
- Khi cho hỗn hợp trên tác dụng với NaOH dư thì chỉ có Al phản ứng. Từ số mol H2 suy ra số mol Al.
- Khi cho hỗn hợp trên tác dụng với HCl thì có Al và Mg đều phản ứng. Từ số mol H2 suy ra số mol Mg.
- Tính khối lượng của hỗn hợp.
Lời giải chi tiết:
- Khi cho hỗn hợp trên tác dụng với NaOH dư thì chỉ có Al phản ứng:
Ta có: \({n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3\left( {mol} \right)\)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3 H2 (1)
0,2 ← 0,3 (mol)
→ mAl = 0,2 . 27 = 5,4 (g)
- Khi cho hỗn hợp trên tác dụng với HCl thì có Al và Mg đều phản ứng:
Ta có: \({n_{{H_2}}} = \frac{{12,32}}{{22,4}} = 0,55\left( {mol} \right)\)
PTHH: Mg + 2HCl → MgCl2 + H2 (3)
0,25 ← 0,55 - 0,3 = 0,25 (mol)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
0,2 → 0,3 (mol)
→ mMg = 0,25. 24 = 6 (g)
Vậy m = mAl + mMg = 5,4 + 6 = 11,4 (g)
Câu hỏi 13 :
Cho m (gam) hỗn hợp Al, Mg tác dụng với dung dịch HCl dư thu được 12,32 lít khí (đktc). Mặt khác, cũng m (gam) hỗn hợp trên cho tác dụng với dung dịch NaOH dư thu được 6,72 lít khí (đktc). Tính giá trị của m?
- A 28,2 gam.
- B 22,8 gam.
- C 14,1 gam.
- D 11,4 gam.
Đáp án: D
Phương pháp giải:
- Khi cho hỗn hợp trên tác dụng với NaOH dư thì chỉ có Al phản ứng. Từ số mol H2 suy ra số mol Al.
- Khi cho hỗn hợp trên tác dụng với HCl thì có Al và Mg đều phản ứng. Từ số mol H2 suy ra số mol Mg.
- Tính khối lượng của hỗn hợp.
Lời giải chi tiết:
- Khi cho hỗn hợp trên tác dụng với NaOH dư thì chỉ có Al phản ứng:
Ta có: \({n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3\left( {mol} \right)\)
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3 H2 (1)
0,2 ← 0,3 (mol)
→ mAl = 0,2 . 27 = 5,4 (g)
- Khi cho hỗn hợp trên tác dụng với HCl thì có Al và Mg đều phản ứng:
Ta có: \({n_{{H_2}}} = \frac{{12,32}}{{22,4}} = 0,55\left( {mol} \right)\)
PTHH: Mg + 2HCl → MgCl2 + H2 (3)
0,25 ← 0,55 - 0,3 = 0,25 (mol)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
0,2 → 0,3 (mol)
→ mMg = 0,25. 24 = 6 (g)
Vậy m = mAl + mMg = 5,4 + 6 = 11,4 (g)
Đáp án D
Câu hỏi 14 :
Cho 8,9 gam hỗn hợp gồm Mg và Zn phản ứng vừa đủ với V1 lít dung dịch HCl 2M, thu được 23,1 gam muối clorua và V2 lít khí H2 (đktc). Giá trị của V1 và V2 lần lượt là
- A 0,2 và 4,48.
- B 0,1 và 4,48.
- C 0,1 và 2,24.
- D 0,1 và 3,36.
Đáp án: A
Phương pháp giải:
Mg + 2HCl → MgCl2 + H2
Zn + 2HCl → ZnCl2 + H2
Dùng định luật BTKL để tìm số mol của H2 và HCl, từ đó tìm được V1 và V2.
Lời giải chi tiết:
Mg + 2HCl → MgCl2 + H2
Zn + 2HCl → ZnCl2 + H2
Đặt số mol H2 là x mol
Theo PTHH ta có: nHCl = 2.nH2 = 2x (mol)
Theo định luật bảo toàn khối lượng: mkim loại + mHCl = mmuối clorua + mH2
→ 8,9 + 2x.36,5 = 23,1 + 2x → x = 0,2
Vậy:
nHCl = 2x = 0,4 (mol) ⟹ V1 = nHCl/CM = 0,4/2 = 0,2 (lít)
nH2 = x = 0,2 mol ⟹ V2 = 0,2.22,4 = 4,48 (lít)
Đáp án A
Câu hỏi 15 :
Hòa tan hoàn toàn m gam Mg bằng dung dịch HCl dư, thu được 2,24 lít H2 (đktc). Giá trị của m là
- A 1,2.
- B 2,4.
- C 3,6.
- D 4,8.
Đáp án: B
Lời giải chi tiết:
Đáp án B
Câu hỏi 16 :
Hòa tan hoàn toàn 1,9 gam hỗn hợp gồm Fe, Mg và Al bằng dung dịch H2SO4 loãng vừa đủ, thu được 1,344 lít H2 (đktc). Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là
- A 7,66 gam.
- B 7,78 gam.
- C 8,25 gam.
- D 7,72 gam.
Đáp án: A
Phương pháp giải:
Sơ đồ: KL + H2SO4 → Muối + H2
Bảo toàn nguyên tố H tính được số mol của H2SO4: nH2SO4 = nH2
Bảo toàn khối lượng tính được khối lượng của muối: mmuối = mKL + mH2SO4 - mH2
Lời giải chi tiết:
Sơ đồ: KL + H2SO4 → Muối + H2
Bảo toàn H → nH2SO4 = nH2 = 1,344/22,4 = 0,06 mol
Bảo toàn khối lượng → mmuối = mKL + mH2SO4 - mH2 = 1,9 + 0,06.98 - 0,06.2 = 7,66 gam
Đáp án A
Câu hỏi 17 :
Cho m gam hỗn hợp X gồm Cu và Mg vào dung dịch H2SO4 loãng (dư), kết thúc phản ứng thu được 3,36 lít khí H2 (đktc). Khối lượng của Mg trong m gam X là
- A 2,4 gam.
- B 3,6 gam.
- C 4,8 gam.
- D 7,2 gam.
Đáp án: B
Phương pháp giải:
Cho hh Mg và Cu vào dd H2SO4 loãng chỉ có Mg pư, Cu không phản ứng.
Đổi số mol H2 theo công thức: nH2(đktc) = VH2/22,4 = ?
Tính số mol Mg theo số mol H2 dựa vào PTHH: Mg + H2SO4 → MgSO4 + H2↑
→ mMg = nMg×MMg = ? (g)
Lời giải chi tiết:
Cho hh Mg và Cu vào dd H2SO4 loãng chỉ có Mg pư, Cu không phản ứng.
nH2(đktc) = VH2 /22,4 = 3,36/22,4 = 0,15 (mol)
PTHH: Mg + H2SO4 → MgSO4 + H2↑
Theo PTHH: nMg = nH2 = 0,15 (mol)
→ mMg = nMg×MMg = 0,15×24 = 3,6 (g)
Đáp án B
Câu hỏi 18 :
Cho 3,87g hỗn hợp X gồm Mg và Al vào 250ml dung dịch Y (chứa hỗn hợp axit HCl 1,0M và H2SO4 0,5M), khi phản ứng kết thúc, thu được 4,368 lít H2 (ở điều kiện tiêu chuẩn). Thành phần phần trăm về khối lượng Mg trong hỗn hợp X là
- A 26,00%.
- B 36,00%.
- C 37,21%.
- D 35,01%.
Đáp án: C
Phương pháp giải:
So sánh thấy nH+ > 2nH2 → Axit dư, kim loại hết
Đặt nMg = x và nAl = y (mol)
+) Từ khối lượng hỗn hợp kim loại → (1)
+) Bảo toàn e → (2)
Giải hệ phương trình được x, y
Tính %mMg
Lời giải chi tiết:
Ta có: nH+ = nHCl + 2nH2SO4 = 0,5 mol; nH2 = 0,195 mol
Nhận thấy nH+ > 2nH2 → Axit dư, kim loại hết
Đặt nMg = x và nAl = y (mol)
+) mhh X = 24x + 27y = 3,87 (1)
+) Áp dụng bảo toàn e: 2nMg + 3nAl = 2nH2 → 2x + 3y = 0,39 (2)
Giải (1) (2) được x = 0,06 và y = 0,09
→ %mMg = (0,06.24/3,87).100% = 37,21%
Đáp án C
Câu hỏi 19 :
Hòa tan hoàn toàn 1,77 gam hỗn hợp X gồm Fe và Zn bằng 1 lượng vừa đủ dung dịch HCl thu được 0,672 lít hiđro (đktc) và dung dịch chứa m gam muối. Giá trị của m là:
- A 3,4
- B 4,6
- C 4,4
- D 3,9
Đáp án: D
Phương pháp giải:
Bảo toàn nguyên tố
Lời giải chi tiết:
Phản ứng tổng quát chung: M + 2HCl → MCl2 + H2
Theo PTHH: nHCl = 2nH2 = 2.(0,672/22,4) = 0,06 mol
BTKL: mX + mHCl = mmuối + mH2
→ 1,77 + 0,06.36,5 = m + 0,03.2
→ m = 3,9 gam
Đáp án D
Câu hỏi 20 :
Cho 8,85 g hỗn hợp Mg, Cu và Zn vào lượng dư dung dịch HCl thu được 3,36 lít H2 (đktc). Phần chất rắn không phản ứng với axit được rửa sạch rồi đốt cháy trong oxi tạo ta 4 g chất bột màu đen. Phần trăm khối lượng của Mg, Cu, Zn lần lượt là
- A 27,12%; 36,72%; 36,16%.
- B 36,16%; 36,72%; 27,12%.
- C 27,12%; 36,16%; 36,72%.
- D 36,16%; 27,12%; 36,72%.
Đáp án: C
Phương pháp giải:
- Viết phương trình hóa học xảy ra
- Mg, Zn phản ứng với dung dịch HCl
- Chất rắn không phản ứng với axit là Cu, từ khối lượng oxit → khối lượng Cu → khối lượng Mg và Zn
- Từ số mol khí H2 và khối lượng Mg, Zn lập hệ phương trình số mol và khối lượng của Mg, Zn → số mol từng chất
- Tính % khối lượng từng chất.
Lời giải chi tiết:
Khi cho hỗn hợp KL vào HCl thì chỉ có Mg và Zn phản ứng, Cu không phản ứng.
(1) Mg + 2HCl → MgCl2 + H2
(2) Zn + 2HCl → ZnCl2 + H2
Chất rắn là Cu, đốt cháy trong oxi thì:
(3) 2Cu + O2 → 2CuO
Theo (3) thì: \({n_{Cu}} = {n_{CuO}} = \frac{4}{{80}} = 0,05(mol) \to {m_{Cu}} = 0,05.64 = 3,2(g)\)
Đặt nMg = x và nZn = y mol
Ta có hệ phương trình: \(\left\{ \begin{array}{l}{m_{hh}} = 24x + 65y + 3,2 = 8,85\\{n_{{H_2}}} = x + y = 0,15\end{array} \right. \to \left\{ \begin{array}{l}x = 0,1\\y = 0,05\end{array} \right.\)
Vậy:
\(\% {m_{Mg}} = \frac{{0,1.24}}{{8,85}}.100\% = 27,12\% \)
\(\% {m_{Cu}} = \frac{{3,2}}{{8,85}}.100\% = 36,16\% \)
\(\% {m_{Zn}} = 100\% - 27,12\% - 36,16\% = 36,72\% \)
Đáp án C
