Câu hỏi 1 :
Điện phân dung dịch chứa 23,4 gam muối ăn (với điện cực trơ, màng ngăn xốp), thu được 2,5 lít dung dịch có pH=13. Phần trăm muối ăn bị điện phân là
- A 62,5%.
- B 65%.
- C 70%.
- D 80%.
Đáp án: A
Phương pháp giải:
viết phương trình phản ứng điện phân, tính toán theo phương trình hóa học
Lời giải chi tiết:
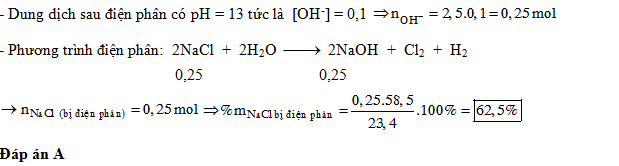
Câu hỏi 2 :
Điện phân nóng chảy hoàn toàn 1,9g muối clorua của kim loại M được 0,48g kim loại M ở catot. Kim loại M là:
- A Zn
- B Ca
- C Mg
- D Ba
Đáp án: C
Phương pháp giải:
Bảo toàn khối lượng, bảo toàn e
Lời giải chi tiết:
Phương pháp: Bảo toàn khối lượng, bảo toàn e
Lời giải:
Bảo toàn khối lượng: mCl2 = 1,9 – 0,48 = 1,42g => nCl2 = 0,02 mol
=> ne cho = 0,04 mol
=> MM = 0,48 : (0,04/n) = 12n
=> M là Mg
Đáp án C
Câu hỏi 3 :
Điện phân một lượng dư dung dịch MgCl2 (điện cực trơ, có màng ngăn xốp bao điện cực) với cường độ dòng điện 2,68A trong 2 giờ. Sau khi dừng điện phân khối lượng dung dịch giảm m gam, giả thiết nước không bay hơi, các chất tách ra đều khan. Giá trị của m là.
- A 8,7
- B 18,9
- C 7,3
- D 13,1
Đáp án: D
Phương pháp giải:
- Tại Catot luôn xảy ra quá trình khử : Mn+ + ne -> Mvà tại Anot luôn xảy ra quá trình oxi hóa : Mn- -> M + ne
Lời giải chi tiết:
Lời giải:
( Mg2+ không bị điện phân)
Anot : 2Cl- -> Cl2 + 2e
Có : ne = It/F = 0,2 mol = 2nH2 = 2nCl2 => nH2 = nCl2 = 0,1 mol
Mg2+ + 2OH- -> Mg(OH)2
=> nMg(OH)2 = ½ nOH- = 0,1 mol
=> m = mMg(OH)2 + mH2 + mCl2 = 13,1g
Đáp án D
Câu hỏi 4 :
Điện phân một dd muối MCln với điện cực trơ. Khi ở catot thu được 16g kim loại M thì ở anot thu được 5,6 lít khí (đktc). Kim loại M là:
- A Mg
- B Fe
- C Cu
- D Ca
Đáp án: C
Phương pháp giải:
bảo toàn e
Lời giải chi tiết:
Lời giải:
nCl2 = 0,25 mol
=> ne cho = 0,5 mol
=> MM = 16 : (0,5/n) = 32n
=> M là Cu
Đáp án C
Câu hỏi 5 :
Điện phân 100 ml dung dịch AgNO3 1M với các điện cực trơ, thời gian điện phân là 14 phút 15 giây, cường độ dòng điện không đổi là 0,8 A (H = 100%). Khối lượng catot tăng lên là:
- A 0,756 gam
- B 0,6486 gam
- C 1,0800 gam
- D 0,9724 gam
Đáp án: A
Phương pháp giải:
Ghi nhớ CT n e trao đổi = It / F
Lời giải chi tiết:
n e trao đổi = (It) : F = (0,8 . 855) : 96500 = 0,007 mol
nAg+ = 0,1 mol
=> Ag+ chưa điện phân hết
m catot tăng = 0,007 . 108 = 0,756g
Đáp án A
Câu hỏi 6 :
Điện phân với điện cực trơ màng ngăn xốp dung dịch chứa 0,10 mol CuSO4 và 0,12 mol NaCl đến khi catot bắt đầu thoát khí thì dừng lại. Thể tích khí (đktc) thu được ở anot là
- A 1,344.
- B 0,896.
- C 1,792.
- D 0,448.
Đáp án: C
Phương pháp giải:
viết các bán phản ứng xảy ra ở catot và anot. Dùng bảo toàn e
Lời giải chi tiết:

Câu hỏi 7 :
Tiến hành điện phân V lít dung dịch NaCl 1M và CuSO4 1,8M bằng điện cực trơ tới khi nước bắt đầu điện phân ở cả hai cực thì dừng điện phân, thấy khối lượng dung dịch giảm m gam. Dung dịch sau phản ứng hòa tan tối đa 8,84 gam Al2O3. Giá trị của m là:
- A 34,5
- B 34,8
- C 34,6
- D 34,3
Đáp án: D
Phương pháp giải:
Bảo toàn e, tăng giảm khối lượng
Lời giải chi tiết:
Vì khi bắt đầu xuất hiện khí cả 2 điện cực thì ngừng điện phân
=> chưa điện phân nước ở Catot
Catot :
Cu2+ + 2e -> Cu
Anot :
2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
Sau đó :
Al2O3 + 6H+ -> 2Al3+ + 3H2O
=> nH+ = 6nAl2O3 = 0,52 mol
bảo toàn e : 2nCu2+ = nCl- + nH+
=> V = 0,2 lit
mdd giảm = mCu + mO2 + mCl2 = 34,3g
Đáp án D
Câu hỏi 8 :
Điện phân 200ml dd CuSO4 0,2M với cường độ dòng điện không đổi trong thời gian t giây thấy có 224ml khí (đktc) thoát ra ở anot. Biết điện cực trơ và hiệu suất phản ứng là 100%. Khối lượng kim loại bám ở catot là:
- A 1,38g
- B 1,28g
- C 1,52g
- D 2,56g
Đáp án: B
Phương pháp giải:
Viết phương trình phản ứng điện phân; tính toán theo phương trình
Lời giải chi tiết:
nCuSO4 = 0,04
n khí = 0,01
Quá trình điện phân
Điện phân dd CuSO4 trước
CuSO4 + H2O → Cu + H2SO4 + 1/2O2
0,04 0,02 => CuSO4 phản ứng không hết
0,02 ← 0,02 ← 0,01
=> mCu = 1.28 g
Đáp án B
Câu hỏi 9 :
Điện phân dd hh chứa 0,04mol AgNO3 và 0,05mol Cu(NO3)2 (điện cực trơ), dòng điện 5A, trong 32phút 10 giây. Khối lượng kim loại bám vào catot là:
- A 6,24g
- B 3,12g
- C 6,5g
- D 7,24g
Đáp án: A
Phương pháp giải:
Viết bán phương trình phản ứng điện tại catot ; bảo toàn eGhi nhớ công thức: n e trao đổi = It / F
Lời giải chi tiết:
ne trao đổi = (1930 . 5) : 96500 = 0,1 mol
Cực âm gồm Ag+ và Cu2+ bị oxh
Ag+ + 1e → Ag
0,04 → 0,04 → 0,04
Cu2+ + 2e → Cu
0,06 → 0,03
mKl = mCu + mAg = 0,04 . 108 + 0,03 . 64 = 6,24g
Đáp án A
Câu hỏi 10 :
Điện phân 10 ml dung dịch AgNO30,4M (điện cực trơ) trong thời gian 10 phút 30 giây với dòng điện có cường độ I = 2A, thu được m gam Ag. Giả sử hiệu suất phản ứng điện phân đạt 100%.
Giá trị của m là:
- A 2,16gam.
- B 1,544gam.
- C 0,432gam.
- D 1,41gam.
Đáp án: C
Phương pháp giải:
Viết bán phương trình phản ứng điện tại catot và anot ; bảo toàn eGhi nhớ công thức: n e trao đổi = It / F
Lời giải chi tiết:

Câu hỏi 11 :
Điện phân hoàn toàn 200ml dung dịch AgNO3 với 2 điên cực trơ thu được một dung dịch có pH= 2. Xem thể tích dung dịch thay đổi không đáng kể thì lượng Ag bám ở catot là
- A 0,540 gam.
- B 0,108 gam.
- C 0,216 gam.
- D 1,080 gam.
Đáp án: C
Phương pháp giải:
Bảo toàn e
Lời giải chi tiết:
Dung dịch sau điện phân có pH = 2 => có H+
Vậy các quá trình diễn ra khi điện phân là :
Catot(-) : Ag+ + 1e -> Ag
Anot(+) : 2H2O -> 4H+ + O2 + 4e
CM(H+) = 10-pH= 0,01 M => nH+ = 0,002 mol
Bảo toàn e : nAg = nH+ = 0,002 mol
=> mAg = 0,216g
Đáp án C
Câu hỏi 12 :
Điện phân 500 ml dung dịch hỗn hợp gồm NaCl 0,1M và AlCl3 0,3M có màng ngăn, điện cực trơ tới khi ở anot bắt đầu xuất hiện khí thứ 2 thì ngừng điện phân. Sau điện phân, lọc lấy kết tủa rồi nung ở nhiệt độ cao đến khối lượng không đổi được m gam chất rắn. Giá trị của m là
- A 7,65.
- B 5,10.
- C 15,30.
- D 10,20.
Đáp án: B
Phương pháp giải:
Na+ và Al3+ không bị khử mà H2O bị khử bên catot theo bán pư: 2H2O +2e → 2OH- + H2
Tại catot có Al3+; OH- => thành bài toán cho a mol Al3+ tác dụng với b mol OH-. Lập tỉ lệ b/a nếu:
+ b/a < 3 => chỉ tạo Al(OH)3 ; n Al(OH)3 = b/3
+ 3< b/a < 4 => tạo Al(OH)3 và [Al(OH)4]- =>Lập hệ 2 ẩn 2 phương trình bảo toàn mol Al3+ và OH- để giải.
+ b/a ≥4 => chỉ tạo [Al(OH)4]-
Lời giải chi tiết:
Ở catot: nOH- = 0,5.0,1 + 0,5.0,3.3 = 0,5 (bảo toàn e, bằng mol e nhường của Cl-)
\({\rm{3 < }}{{{{\rm{n}}_{{\rm{O}}{{\rm{H}}^{\rm{ - }}}}}} \over {{{\rm{n}}_{{\rm{A}}{{\rm{l}}^{{\rm{3 + }}}}}}}}{\rm{ = }}{{{\rm{0,5}}} \over {{\rm{0,15}}}}{\rm{ = 3,33 < 4 }}\) => tạo Al(OH)3 và [Al(OH)4]-
Ta có hệ:
nAl(OH)3 + n[Al(OH)4]- = 0,15
3n Al(OH)3 + 4n[Al(OH)4]- = 0,5
=> nAl(OH)3 = 0,1 mol
=> nAl2O3 = 0,05 mol
=> m = 5,1
Đáp án B
Câu hỏi 13 :
Điện phân 200 ml dung dịch muối CuSO4 trong thời gian, thấy khối lượng dung dịch giảm 8 gam. Dung dịch sau điện phân cho tác dụng với dd H2S dư thu được 9,6g kết tủa đen. Nồng độ mol của dung dịch CuSO4 ban đầu là
- A 2M.
- B 1,125M.
- C 0,5M.
- D 1M.
Đáp án: D
Phương pháp giải:
Viết các bán phản ứng tại catot và anot.
Bảo toàn electron (mol e bên catot nhường bằng mol e bên anot nhận).
Khối lượng dung dịch giảm: ∆ = mKL↓ + m khí↑
Lời giải chi tiết:
Quá trình điện phân có thể xảy ra các phản ứng :
Catot(-) :
Cu2+ + 2e -> Cu
2H2O + 2e -> H2 + 2OH- (*)
Anot(+) :
2H2O -> 4H+ + O2 + 4e
Sau điện phân : Cu2+ + S2- -> CuS↓ (đen) => nCu2+ dư = nCuS = 0,1 mol
=> Chứng tỏ Cu2+ dư => Chưa có quá trình (*)
Gọi số mol Cu2+ bị điện phân là x mol => nO2 = 0,5x mol
=> mdd giảm = mCu + mO2 = 64x + 32.0,5x = 8g => x = 0,1 mol
=> nCu2+ bđ = nCu2+ dư + nCu2+ đp = 0,2 mol
=> CM(CuSO4) = 1M
Đáp án D
Câu hỏi 14 :
Điện phân (điện cực trơ, hiệu suất 100%) 300 ml dung dịch CuSO4 0,5M với cường độ dòng điện không đổi 2,68 A, trong thời gian t giờ thu được dung dịch X. Cho dung dịch Ba(OH)2 dư vào X thấy xuất hiện 45,73 gam kết tủa. Giá trị của t là
- A 0,10.
- B 0,12.
- C 0,4.
- D 0,8.
Đáp án: D
Phương pháp giải:
CT tính số mol e trao đổi: ne = It/F
Bảo toàn e
Lời giải chi tiết:
Bảo toàn nguyên tố SO42- ta có:
nBaSO4 = nSO42- = 0,3.0,5 = 0,15 (mol)
Bảo toàn khối lượng ta có:
mBaSO4 + mCu(OH)2 = 45,73 (g)
=>mCu(OH)2= 45,73 - 0,15.233 = 10,78 (g)
=> nCu(OH)2 = 10,78 : 98 = 0,11 (mol)
=> 45,73 gam tủa có 0,15 mol BaSO4 + 0,11 mol Cu(OH)2
=> lượng Cu phản ứng là 0,04 mol => e trao đổi là 0,08 mol
=> t = 0,08 x 96500 : 2,68 : 3600 = 0,8 giờ
Đáp án D
Câu hỏi 15 :
Điện phân dung dịch hỗn hợp CuSO4 và KCl với điện cực trơ, có màng ngăn xốp. Khi ở cả hai điện cực đều có bọt khí thì dừng lại. Kết quả ở anot có 448ml khí thoát ra (dktc), khối lượng dung dịch sau điện phân giảm m gam và dung dịch sau điện phân có thể hòa tan tối đa 0,8 gam MgO. Giá trị của m là :
- A 2,95
- B 2,89
- C 2,14
- D 1,62
Đáp án: A
Phương pháp giải:
Dựa vào thứ tự điện phân của các ion để tính toán.
Lời giải chi tiết:
Lời giải:
Dung dịch sau điện phân có thể hòa tan MgO => có H+
Catot : Cu2+ + 2e -> Cu
Anot : 2Cl- -> Cl2 + 2e
2H2O -> 4H+ + O2 + 4e
MgO + 2H+ -> Mg2+ + H2O
=> nH+ = 0,04 mol => nO2 = 0,01 mol
Có : nKhí = nCl2 + nO2 => nCl2 = 0,01 mol
Bảo toàn e : 2nCu = nH+ + 2nCl2 => nCu = 0,03 mol
=> m = mCu + mO2 + mCl2 = 2,95g
Đáp án A
Câu hỏi 16 :
Cho một dòng điện có cường độ không đổi đi qua 2 bình điện phân mắc nối tiếp. Bình 1 chứa 500 ml dung dịch CuSO4(điện cực trơ), bình 2 chứa 100 ml dung dịch hỗn hợp AgNO3 0,2M; Cu(NO3)2 0,3M, Fe(NO3)3 0,1M (điện cực trơ). Sau một thời gian ngắt dòng điện, thấy bình 1 có pH =1 và catot của bình 2 tăng thêm m gam. Biết thể tích dung dịch không thay đổi trong suốt quá trình điện phân. Giá trị của m là
- A 1,72.
- B 2,16.
- C 3,44.
- D 2,80.
Đáp án: D
Phương pháp giải:
Viết các bán phản ứng xảy ra tại anot và catot. Bảo toàn electron
CT tính số mol e trao đổi: ne = It/F
Khối lượng catot tăng: ∆= mKL
Lời giải chi tiết:
+/Bình 1: Tại Anot: 2H2O → 4H+ + O2 + 4e
Do pH = 1 => n H+ = 0,1.0,5 = 0,05 mol
Do 2 bình mắc nối tiếp nên I1 = I2 => số mol e trao đổi như nhau ở 2 bình
=> n e trao đổi = 0,05 mol
+/Bình 2: Tại Catot : Fe3+ + 1e → Fe2+
Ag+ + 1e → Ag
Cu2+ + 2e → Cu
=> m = m Ag + m Cu = 108.0,02 + 64.0,01 =2,8g
Đáp án D
Câu hỏi 17 :
Điện phân dung dịch chứa 0,2 mol NaCl và x mol Cu(NO3)2 (điện cực trơ,màng ngăn xốp) sau một thời gian thu được dung dịch X và khối lượng dung dịch giảm 21,5 gam. Cho thanh sắt vào dung dịch X đến khi các phản ứng xảy ra hoàn toàn thấy khối lượng thanh sắt giảm 2,6 gam và thấy thoát ra khí NO duy nhất. Giá trị của x là :
- A 0,4
- B 0,2
- C 0,3
- D 0,5
Đáp án: A
Phương pháp giải:
Viết các phương trình điện phân.
Bảo toàn electron, tăng giảm khối lượng.
Lời giải chi tiết:
Ta có Cu(NO3)2 + 2NaCl → Cu + Cl2 + 2NaNO3
0,1 0,2 0,1 0,1
Cu(NO3)2 + H2O → Cu + 1/ O2 + 2HNO3
a a 0,5a
ta có m dung dịch giảm =(0,1 + 0,5a) . 64 + 0,1.71 + 0,5a . 32 = 21,5
=> a = 0,1
=> nH+ = 2a = 0,2 (mol)
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,075 ← 0,2
Fe + Cu2+ → Fe2+ + Cu
b b b
m Fe giảm = 56(0,075 + b) - 64b = 2,6
b = 0,2
Vậy x=0,4
Đáp án A
Câu hỏi 18 :
Tiến hành điện phân 200 ml dung dịch X gồm HCl 0,8M và CuSO4 1M với cường độ dòng điện không đổi I = 2,68 ampe trong thời gian 2 giờ (điện cực trơ, có màng ngăn xốp, hiệu suất điện phân 100%). Coi các khí tan trong nước không đáng kể. Tính thể tích khí thoát ra ở anot ( ở đktc) là:
- A 1,792 lít.
- B 2,016 lít.
- C 2,688 lít.
- D 2,240 lít.
Đáp án: B
Phương pháp giải:
Bảo toàn eGhi nhớ công thức: ne = It/F
Lời giải chi tiết:
ne = It/F = 2,68.(2.3600)/96500 = 0,2 mol
Xét tại anot (+): Cl- và H2O bị điện phân
nCl- = nHCl = 0,16 mol
Cl- → 0,5 Cl2 + 1e
0,16 → 0,08 → 0,16
=> ne còn lại = 0,2 – 0,16 = 0,04 mol
=> H2O có bị điện phân
H2O → 2H+ + 0,5O2 + 2e
0,01 ← 0,04 (mol)
Vậy khí thu được gồm 0,08 mol Cl2 và 0,01 mol O2.
=> V = (0,08 + 0,01).22,4 = 2,016 lít
Câu hỏi 19 :
Điện phân (với điện cực trơ) 200ml dd CuSO4 nồng độ x M, sau một thời gian thu được dd Y vẫn còn màu xanh, có khối lượng giảm 8g so với dd ban đầu. cho 16,8g bột Fe vào Y, sau phản ứng hoàn toàn, thu được 12,4g kim loại. Giá trị của X là:
- A 1,5
- B 3,25
- C 2,25
- D 1,25
Đáp án: D
Phương pháp giải:
Viết các bán phản ứng xảy ra tại catot và anot.
Đặt số mol e dưới chân các phản ứng, tính toán theo bán phương trình.
Phương pháp tăng giảm khối lượng
Lời giải chi tiết:
Sau điện phân dung dịch vẫn còn màu xanh => CuSO4 dư
Quá trình điện phân :
Catot : Cu2+ + 2e -> Cu
(mol) t -> 2t -> t
Anot : 2H2O -> 4H+ + O2 + 4e
(mol) 2t
=> mgiảm = mCu + mO2 => t = 0,1 mol
Khi cho Fe vào dung dịch sau phản ứng thì :
Fe + Cu2+ -> Fe2+ + Cu
(0,2x – 0,1) -> (0,2x – 0,1)
Fe + 2H+ -> Fe2+ + H2
0,1
=> mKL trước – mKL sau = mFe pứ - mCu tạo ra
=> 16,8 – 12,4 = 56.(0,2x – 0,1 + 0,1) – 64.(0,2x – 0,1)
=> x = 1,25 M
Đáp án D
Câu hỏi 20 :
Tiến hành điện phân 500 ml dung dịch Cu(NO3)2 0,1M (điện cực trơ) với cường độ I = 19,3A trong thời gian 400 giây và ngắt dòng điện để yên bình điện phân để phản ứng xảy ra hoàn toàn (tạo khí NO là sản phẩm khử duy nhất) thu được dung dịch X. Khối lượng dung dịch X giảm so với ban đầu là :
- A 3,80g
- B 1,28g
- C 1,88g
- D 1,24g
Đáp án: C
Phương pháp giải:
Bảo toàn eGhi nhớ CT ne = It/FĐộ giảm dung dịch ∆ = m kim loại↓ + m khí↑ne = It/F = 0,08 mol
Lời giải chi tiết:
ne = It/F = 0,08 mol
Catot : Cu2+ + 2e -> Cu
Mol 0,04 -> 0,08 -> 0,04
Anot : 2H2O -> 4H+ + O2 + 4e
Mol 0,08
Vậy dung dịch sau phản ứng có : 0,01 mol Cu2+ ; 0,1 mol NO3- ; 0,08 mol H+
3Cu + 8H+ + 2NO3- -> 3Cu2+ + 2NO + 4H2O
0,03 <-0,08 -> 0,02 (mol)
Vậy dung dịch mất đi : 0,02 mol NO và 0,02 mol O2 ; 0,01 mol Cu
=> mgiảm = 1,88g
Đáp án C
Câu hỏi 21 :
Điện phân 500 ml dung dịch CuSO4 đến khi thu được 1,344 lit khí (dktc) ở anot thì dừng lại. Ngâm thanh Al trong dung dịch sau điện phân. Sau khi phản ứng xảy ra hoàn toàn thấy khối lượng thanh Al tăng 6,12g. Nồng độ mol/lit ban đầu của CuSO4 là :
- A 0,553M
- B 0,6M
- C 0,506M
- D 0,24M
Đáp án: B
Phương pháp giải:
Bảo toàn e, tăng giảm khối lượng
Lời giải chi tiết:
Do khối lượng thanh Al tăng nên dung dịch sau điện phân có chứa Cu2+
=> Cu2+ bị điện phân chưa hết
Anot:
H2O - 2e → 2H+ + 0,5O2
0,24 ← 0,24 ← 0,06
Catot:
Cu2+ + 2e → Cu
0,24 → 0,12
DD sau điện phân có chứa: Cu2+ (x mol); H+ (0,24 mol); SO42-
2Al + 6H+ → 2Al3+ + 3H2 (1)
0,08 ← 0,24
2Al + 3Cu2+ → 2Al3+ + 3Cu (2)
x → 1,5x → 1,5x
m thanh Al tăng = m bám – m tan = mCu(2) – (mAl(2) + mAl(1))=> 64.1,5x – (27x + 27.0,08) = 6,12
=> x = 0,12
=> nCuSO4 bđ = 0,12 + 1,5x = 0,3 mol
=> CM = 0,3 : 0,5 = 0,6M
Đáp án B
Câu hỏi 22 :
Điện phân (với điện cực trơ, có màng ngăn) m gam dung dịch chứa 0,1 mol FeCl3 và 0,15 mol HCl với cường độ dòng điện không đổi 1,92A. Sau một thời gian t giờ thì dung dịch thu được sau điện pân có khối lượng (m – 5,156). Biết trong quá trình điện phân nước bay hơi không đáng kể. Giá trị của t là:
- A 2,5
- B 2
- C 3
- D 1.,5
Đáp án: B
Phương pháp giải:
CT tính số mol e trao đổi ne = It/F
Bảo toàn electron
Lời giải chi tiết:
Ta thấy lượng khí sinh ra chính là clo và hidro.
BTNT "Cl": nCl = 3nFeCl3 + nHCl = 3.0,1 + 0,15 = 0,45 mol
Mà mCl = 0,45.35,5 = 15,975 g > m khí = 5,156 g => Cl- chưa bị điện phân hết
Quá trình: + Anot : 2Cl- → Cl2 + 2e
+ Catot: Fe3+ + 1e → Fe2+
2H+ +2e → H2
Đặt n Cl2 = x mol => n e trao đổi = 2x = n Fe3+ + 2n H2
=> n H2 = (x-0,05) mol
=> m khí = 2(x-0,05) + 71x = 5,156 => x = 0,072 mol
=>n e trao đổi = It/F => t = 7200s = 2h
Đáp án B
Câu hỏi 23 :
Điện phân 10ml dung dịch AgNO3 0,4M ( điện cực trơ) trong thời gian 10 phút 30 giây với dòng điện có cường độ I=2A, thu được m gam Ag. Giả sử hiệu suất phản ứng điện phân đạt 100%. Giá trị m là:
- A 2,16g
- B 1,544g
- C 0,432g
- D 1,41g
Đáp án: C
Lời giải chi tiết:
Đáp án C
$\begin{gathered}
{n_e} = \frac{{I.t}}{F} = 0,013 \hfill \\
{n_{AgN{O_3}}} = 0,004mol \hfill \\
\Rightarrow m = 0,432g \hfill \\
\end{gathered} $
Câu hỏi 24 :
Điện phân dung dịch X chứa 0,2 mol CuSO4 và 0,12 mol NaCl bằng dòng điện có cường độ 2A (điện cực trơ, màng ngăn xốp) trong thời gian 9650 giây. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch giảm m gam so với trước khi điện phân (giả sử lượng nước bay hơi không đáng kể). Giá trị của m là
- A 7,04.
- B 11,3.
- C 6,4.
- D 10,66.
Đáp án: B
Lời giải chi tiết:
ne = 0,2 mol→∆m gồm : 0,1 mol Cu; 0,06 mol Cl2;0,02 mol O2→∆m = 11,3 gam
Đáp án B
Câu hỏi 25 :
Điện phân 500ml dung dịch chứa hỗn hợp gồm CuSO4 aM và NaCl 0,75M với điện cực tro cường độ dòng điện 5A . Sau thời gian điện phân 96,5 phút, khối lượng dung dịch giảm 17,15 gam. Giá trị của a là
- A 0,2
- B 0,5
- C 0,1
- D 0,4
Đáp án: A
Phương pháp giải:
Bảo toàn e
Ghi nhớ công thức: ne = It/ F
Khối lượng dung dịch giảm ∆ = m↓ + m↑
Chú ý: Na+ và SO4 2- không bị điện phân mà khi đó H2O sẽ bị điện phân
Lời giải chi tiết:
ne = It/F = 5.96,5.60/96500 = 0,3 mol
TH1: Ở catot nước chưa bị điện phân, Cu2+ bị điện phân chưa hết (hoặc vừa hết)
Catot (-):
Cu2+ + 2e → Cu
0,3 → 0,15
Anot (+):
2Cl- → Cl2 + 2e
0,15 ← 0,3
=> m dd giảm = mCu + mCl2 = 0,15.64 + 0,15.71 = 20,25 gam ≠ 17,15 gam (loại)
TH2: Ở catot Cu2+ đã điện phân hết, H2O đã bị điện phân
Tại catot (-) Tại anot (+)
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
0,5 a→ a → 0,5a 0,15 ← 0,3
2H2O + 2e → H2 + 2OH-
b → 0,5b
\(\left\{ {\matrix{{a + b = 0,3} \cr {0,5a.64 + 0,5b.2 + 0,15.71 = 17,15} \cr} = > \left\{ {\matrix{{a = 0,2} \cr {b = 0,1} \cr} } \right.} \right.\)
Nồng độ của CuSO4 = a = 0,2 M
Đáp án A
Câu hỏi 26 :
Điện phân hỗn hợp 0,2 mol NaCl và a mol Cu(NO3)2 sau một thời gian thu được dung dịch X và khối lượng dung dịch X giảm 21,5. Cho thanh sắt vào dung dịch X đến phản ứng hoàn toàn thấy khối lượng thanh sắt giảm 2,6 gam và thoát ra khí NO duy nhất. Tính a?
- A
0,5.
- B
0,6.
- C
0,4.
- D
0,2.
Đáp án: C
Lời giải chi tiết:
n Cl = 0,2 mol => n Cl2 = 0,1 mol
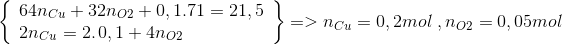
2 H2O → 4 H+ + O2 + 4 e
n O2 = 0,05 mol => n H+ = 0,2 mol = n HNO3
Fe + 4 HNO3→ Fe(NO3)3 + 2 H2O + NO
0,05 <= 0,2 => 0,05
Fe + 2 Fe(NO3)3 → 3 Fe(NO3)2
0,025 <=0,05
=> m Fe = 56 . ( 0,025 + 0,05 ) = 4,2 gam > 2,6 gam
=> có phản ứng của Fe với muối Cu2+
Fe + Cu(NO3)2→ Fe(NO3)2 + Cu
=> m tăng của phản ứng = 4,2 – 2,6 = 1,6 g
=> n Cu(NO3)2 = 1,6 : (64 – 56 ) = 0,2 mol ( tăng theo thực tế chia cho tăng theo 1 mol )
tổng số mol = 0,2 + 0,2 = 0,4 mol
Đáp án C
Câu hỏi 27 :
Điện phân dung dịch hỗn hợp chứa 0,04 mol AgNO3 và 0,05 mol Cu(NO3)2, điện cực trơ, dòng điện 5A, trong 32 phút 10 giây khối lượng kim loại bám vào catot là:
- A 3,12g
- B 6,24g
- C 7,24g
- D 6,5g
Đáp án: B
Phương pháp giải:
+ Công thức: ne trao đổi = IT/F
+ Viết thứ tự các chất bị điện phân tại catot theo quy tắc Ag+ trước Cu2+ bị điện phân sau
Lời giải chi tiết:
ne trao đổi = IT/F = 5. 1930/96500 = 0,1 (mol)
Catot (-)
Ag+ + 1e→ Ag
0,04← 0,04→ 0,04
Cu2+ + 2e → Cu
(0,1- 0,04) → 0,03
=> mKL = mAg + mCu = 0,04.108 + 0,03.64 = 6,24 (g)
Đáp án B
Câu hỏi 28 :
Điện phân dung dịch CuSO4 một thời gian thu được tổng thể tích khí là 11,2 lít. Trong đó một nửa lượng khí được sinh ra từ cực dương và một nửa được sinh ra từ cực âm. Khối lượng CuSO4 có trong dung dịch là
- A 40 gam
- B 20 gam.
- C 10 gam.
- D 80 gam.
Đáp án: A
Phương pháp giải:
nOxi = nH2 = 0,5:2=0,25 mol
CuSO4
(-) (+)
Cu+2 +2e → Cu H2O -2e → 2H+ + 1/2 O2
x 2x 1 0,25
2H2O +2e → H2 + 2OH-
0,5 0,25
ĐLBT số mol e => ne cho = ne nhận
=> x=> mCuSO4
Lời giải chi tiết:
nOxi = nH2 = 0,5:2=0,25 mol
CuSO4
(-) (+)
Cu+2 +2e → Cu H2O -2e → 2H+ + O2
x 2x 1 0,25
2H2O +2e → H2 + 2OH-
0,5 0,25
ĐLBT số mol e => ne cho = ne nhận
=> 2x+ 0,5= 1=> x=0,25 mol
=> mCuSO4 = 160.0,25 = 40 (g)
Đáp án A
Câu hỏi 29 :
Khi điện phân muối clorua kim loại nóng chảy, người ta thu được 0,896 lít khí (đktc) ở anot và 3,12 gam kim loại ở catot. Công thức muối clorua đã điện phân là
- A NaCl.
- B CaCl2.
- C KCl.
- D MgCl2
Đáp án: C
Phương pháp giải:
nClo = 0,896:22,4=0,04 mol
2MCln → 2 M + nCl2
0,08/n 0,04
=> M
Lời giải chi tiết:
nClo = 0,896:22,4=0,04 mol
2MCln → 2 M + nCl2
0,08/n 0,04
=> M= 3,12: (0,08/n)= 39n
=> n=1, M=39 (K)
=> muối là KCl
Đáp án C
Câu hỏi 30 :
Hoà tan 0,585 gam NaCl vào nước rồi đem điện phân với điện cực trơ có màng ngăn xốp, thu được 500ml dung dịch có pH = 12. Hiệu suất điện phân là:
- A 25%
- B 45%
- C 50%
- D 60%
Đáp án: C
Phương pháp giải:
pH= 12 => [H+] = 10-12 => [OH-] = \(\frac{{{{10}^{ - 14}}}}{{{{10}^{ - 12}}}} = {10^{ - 2}}\)
=> nOH- = 10-2 .0,5=0,005 mol
NaCl → Na+ + Cl-
Catot(-) Anot(+)
Na+,H2O Cl-,H2O
2H2O +2e → H2 + 2OH- 2Cl‑ → Cl2 + 2e
=> mNaCl(p/u)
=> H=\(\frac{{{m_{p/u}}}}{{{m_{b{\text{d}}}}}}.100\% \)
Lời giải chi tiết:
pH= 12 => [H+] = 10-12 => [OH-] = \(\frac{{{{10}^{ - 14}}}}{{{{10}^{ - 12}}}} = {10^{ - 2}}\)
=> nOH- = 10-2 .0,5=0,005 mol
NaCl → Na+ + Cl-
Catot(-) Anot(+)
Na+,H2O Cl-,H2
2H2O +2e → H2 + 2OH 2Cl‑ → Cl2 + 2e
0,005 0,005 0,005 0,005
=> mNaCl(p/u) = 0,005 . 58,5=0,2925
=> H= \(\frac{{{m_{p/u}}}}{{{m_{b{\text{d}}}}}}.100\% = \frac{{0,2925}}{{0,585}}.100\% = 50\% \)
Đáp án C
Câu hỏi 31 :
Điện phân (điện cực trơ) dung dịch X chứa 0,2 mol CuSO4 và 0,12 mol NaCl bằng dòng điện có cường độ 2A. Thể tích khí (đktc) thoát ra ở anot sau 9650 giây điện phân là
- A 1,344 lít.
- B 2,240 lít.
- C 1,792 lít.
- D 2,912 lít.
Đáp án: C
Phương pháp giải:
nCu2+ = 0,2 mol; nCl- = 0,12 mol
Na+, SO42- không tham gia điện phân
Catot (-) : Cu2+ , Na+, H2O Anot (+) : Cl-, SO42-, H2O
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
0,06 ←0,12 → 0,06 0,12 → 0,06 0,12
Số mol Cu giải phóng ra ở catot sau 9650 giây điện phân: nCu = \(\frac{{It}}{{nF}} = \frac{{2.9650}}{{2.96500}}\)= 0,1 mol
Khi điện phân hết ion Cl- chỉ mới thu được 0,06 mol Cu nên Cu2+ tiếp tục điện phân để tạo ra 0,1 – 0,06 = 0,04 mol Cu nữa. Mà khi bên catot ion Cu2+ tiếp tục điện phân thì bên anot do Cl- đã điện phân hết nên H2O sẽ tiếp tục điện phân.
→ V
Lời giải chi tiết:
nCu2+ = 0,2 mol; nCl- = 0,12 mol
Na+, SO42- không tham gia điện phân
Catot (-) : Cu2+ , Na+, H2O Anot (+) : Cl-, SO42-, H2O
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
0,06 ←0,12 → 0,06 0,12 → 0,06 0,12
Số mol Cu giải phóng ra ở catot sau 9650 giây điện phân: nCu = \(\frac{{It}}{{nF}} = \frac{{2.9650}}{{2.96500}}\) = 0,1 mol
Khi điện phân hết ion Cl- chỉ mới thu được 0,06 mol Cu nên Cu2+ tiếp tục điện phân để tạo ra 0,1 – 0,06 = 0,04 mol Cu nữa. Mà khi bên catot ion Cu2+ tiếp tục điện phân thì bên anot do Cl- đã điện phân hết nên H2O sẽ tiếp tục điện phân.
Cu2+ + 2e → Cu H2O →1/2 O2 +2 H+ + 2e
0,08 ← 0,04 0,02 ←0,08
→ Thể tích khí (đktc) thoát ra ở anot: V = VCl2 + VO2 =( 0,06 + 0,02) . 22,4 = 1,792 lít
Đáp án C
Câu hỏi 32 :
Tiến hành điện phân (với điện cực trơ) V lít dung dịch CuCl2 0,5M. Khi dừng điện phân thu được dung dịch X và 3,36 lít khí Cl2 (đktc) duy nhất ở anot. Toàn bộ dung dịch X tác dụng vừa đủ với 0,84 gam Fe. Giá trị của V là
- A 0,03
- B 0,33
- C 0,30
- D 0,63V
Đáp án: B
Lời giải chi tiết:
nFe = 0,015 mol => nCuCl2 = 0,015 mol
nCl2 = 0,15 mol => nCuCl2 phản ứng = 0,15 mol
=> nCuCl2 = 0,165 mol
=> V = 0,33 lít
Đáp án B
Câu hỏi 33 :
Điện phân dung dịch hỗn hợp chứa 0,02 mol AgNO3 và 0,03 mol Cu(NO3)2 với điện cực trơ, cường độ dòng điện I = 2A trong 32 phút 10 giây. Khối lượng kim loại bám vào catot là:
- A 3,44
- B 2,16
- C 1,28
- D 2,8
Đáp án: D
Lời giải chi tiết:
n e trao đổi = It/F = 0,04 mol
Ag+ + 1e→ Ag
0,02 0,02 0,02
Cu2+ + 2e → Cu
0,01 0,02 0,01
m kim loại = mCu + mAg = 2,8
Đáp án D
Câu hỏi 34 :
Điện phân 300ml dung dịch chứa NaCl với điện cực trơ, có màng ngăn, cường độ dòng điện không đổi 0,965A. Tính thời gian điện phân để được dung dịch pH = 12. Coi thể tích dung dịch thay đổi không đáng kể, hiệu suất điện phân là 100%.
- A 50s
- B 100s
- C 300s
- D 200s
Đáp án: C
Lời giải chi tiết:
pH = 12 => [OH-] = 0,01 mol
nOH- = 0,003 mol
H2O + e → 1/2 H2 + OH-
0,003 ← 0,003
n e trao đổi = 0,003 = It/ F
=> t = 300s
Đáp án C
Câu hỏi 35 :
Điện phân (điện cực trơ) dung dịch X chứa 0,1 mol CuSO4 và 0,08mol NaCl bằng dòng điện có cường độ 1A trong thời gian là 9650 giây. Kết luận nào dưới đây chính xác
- A Dung dịch sau phản ứng có pH > 7
- B Thể tích khí thoát ra ở anot = 0,896 lít
- C Khối lượng dung dịch giảm = 3,2g
- D Dung dịch sau phản ứng có khả năng hòa tan tối đa 3,92g Fe
Đáp án: D
Lời giải chi tiết:
n e trao đổi = \(\frac{{It}}{F} = \frac{{1.96500}}{{96500}} = 0,1\,mol\)
nCu2+ = 0,1 mol
nCl- = 0,02 mol
Catot Anot
Cu2+ + 2e → Cu 2Cl- → Cl2 + 2e
0,1 0,05 0,04 0,08
2H2O → O2 + 4H+ + 4e
0,005 ←0,02 ← 0,02
- Nước ở anot đã điện phân và nước ở catot chưa điện phân => dd sau phản ứng có Ph < 7
- Vkhí = VCl2 + VO2 = 1,008 lít
- mgiảm = mCu + mCl2 + mO2 = 6,2g
- nCu2+ dư = 0,05 mol ; nH+ = 0,02 mol
nFe = nCu2+ + nH+ = 0,07 mol
=> mFe = 3,92g
Đáp án D
Câu hỏi 36 :
Điện phân dung dịch hỗn hợp gồm 0,05 mol FeCl3, 0,1 mol CuCl2 và 0,2 mol HCl (điện cực trơ). Khi ở catot bắt đầu thoát khí thì ở anot thu được V lít khí (đktc). Tính V
- A 0,56
- B 3,92
- C 2,8
- D 6,16
Đáp án: C
Lời giải chi tiết:
Thứ tự điện phân
nFe3+ = 0,05 mol
nCu2+ = 0,1 mol
nH+ = 0,2 mol
nCl- = 0,55 mol
Khi catot bắt đầu điện phân chứng tỏ H+ bắt đầu điện phân
Catot Anot
Fe3+ + 1e → Fe2+ 2Cl- → Cl2 + 2e
0,05 0,05 0,125 ←0,25
Cu2+ + 2e → Cu
0,1 →0,2
V = 2, 8 lít
Đáp án C
Câu hỏi 37 :
Điện phân đến hết 0,1 mol Cu(NO3 )2 trong dung dịch với điện cực trơ, thì sau điện phân khối lượng dung dịch đã giảm bao nhiêu gam ?
- A 1,6 gam
- B 6,4 gam
- C 8,0 gam
- D 18,8 gam
Đáp án: C
Phương pháp giải:
Cu(NO3)2
Catot (-)
Anot (+)
Cu+2 +2e Cu
H2O -2e2H+ + O2
=> mdd giảm = mCu + mO2
Lời giải chi tiết:
Cu(NO3)2
Catot (-)
Anot (+)
Cu+2 +2e Cu
0,1 0,2 0,1
H2O -2e2H+ + O2
0,1 0,2 0,05
mdd giảm = mCu + mO2 = 0,1.64+ 0,05.32 = 8 gam
Đáp án C
Câu hỏi 38 :
Điện phân với điện cực trơ dung dịch chứa 0,3 mol AgNO3 bằng cường độ dòng điện 2,68 ampe, trong thời gian t (giờ) thu được dung dịch X. Cho 22,4 gam bột Fe vào dung dịch X thấy thoát ra khí NO ( sản phẩm khử duy nhất) thu được 34,28 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị của t là:
- A 1,00 .
- B 1,20.
- C 1,25
- D 1,40
Đáp án: B
Phương pháp giải:
+ Viết PTHH phản ứng điện phân
+ Fe dư sau phản ứng nên tạo muối Fe2+
+ Tính toán theo phương trình, dùng phương pháp tăng giảm khối lượng: ∆m rắn tăng = mAg sinh ra – mFe pư
Lời giải chi tiết:
4AgNO3 + 2H2O \(\xrightarrow{{dp{\text{dd}}}}\) 4Ag + 4HNO3 + O2
x → x (mol)
Dd X gồm: HNO3: x (mol); AgNO3 dư : 0,3 – x (mol)
Cho Fe vào dd X, sản phẩm thu được có Fe dư ( Vì mAg < 0,3. 108 < 34,28)
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
0,25x ← x → 0,25x
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
0,125x ←0,25x
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
(0,15-0,5x)←(0,3-x)
∆m rắn tăng = mAg sinh ra – mFe pư
=> 34,28 – 22,4 = ( 0,3 – x). 108 – ( 0,25x + 0,125x + 0,15– 0,5x). 56
=> 11, 88 = 24-101x
=> x = 0,12 (mol)
=> nAg+ bị điện phân = 0,12 = It/F
=> t = 0,12. 96500/ 2,68 = 4320 (s) = 1,2 h
Đáp án B
Câu hỏi 39 :
Tiến hành điện phân 500 ml dung dịch Cu(NO3)2 0,1M (điện cực trơ) với cường độ I = 19,3A trong thời gian 400 giây và ngắt dòng điện để yên bình điện phân để phản ứng xảy ra hoàn toàn (tạo khí NO là sản phẩm khử duy nhất) thu được dung dịch X. Khối lượng dung dịch X giảm so với ban đầu là :
- A 3,80g
- B 1,28g
- C 1,88g
- D 1,24g
Đáp án: C
Phương pháp giải:
+ Dùng công thức: ne = It/F
+ Viết các bán phản ứng xảy ra tại catot và anot, tính toán theo các bán phản ứng
Catot : Cu2+ + 2e → Cu
Anot : 2H2O → 4H+ + O2 + 4e
+ PT ion rút gọn: 3Cu + 8H+ + 2NO3- →3Cu2+ + 2NO + 4H2O
=> mgiảm = mNO + mO2 + mCu
Lời giải chi tiết:
ne = It/F = 0,08 mol
Catot : Cu2+ + 2e → Cu
Mol 0,04 → 0,08 → 0,04
Anot : 2H2O → 4H+ + O2 + 4e
Mol 0,08 ←0,02 ← 0,08
Vậy dung dịch sau phản ứng có : 0,01 mol Cu2+ ; 0,1 mol NO3- ; 0,08 mol H+
3Cu + 8H+ + 2NO3- →3Cu2+ + 2NO + 4H2O
0,03 ←0,08 → 0,02 (mol)
Vậy dung dịch mất đi : 0,02 mol NO và 0,02 mol O2 ; 0,01 mol Cu
=> mgiảm = 1,88g
Đáp án C
Câu hỏi 40 :
Điện phân 500 ml dung dịch CuSO4 0,2M (điện cực trơ) cho đến khi ở catot thu được 3,2 gam kim loại thì thể tích khí (đktc) thu được ở anot là:
- A 3,36 lít
- B 1,12 lít
- C 0,56 lít
- D 2,24 lít
Đáp án: C
Lời giải chi tiết:
nCu2+ = 0,1 mol
nCu = 0,05 mol < 0,1
=> Cu2+ chưa phản ứng hết
Cu2+ +1e→ Cu 2H2O → 4H+ + O2 + 4e
0,1 ← 0,05 0,025 ← 0,1
=> V = 0,56 lít
Đáp án C
Câu hỏi 41 :
Điện phân dung dịch hỗn hợp gồm 0,1 mol FeCl3, 0,2 mol CuCl2 và 0,1 mol HCl (điện cực trơ). Khi ở catot bắt đầu thoát khí thì ở anot thu được V lít khí (đktc). Biết hiệu suất của quá trình điện phân là 100%. Giá trịcủa V là :
- A 5,60.
- B 11,20.
- C 4,48.
- D 22,40.
Đáp án: A
Phương pháp giải:
Thứ tự điện phân:
Ở catot: ion nào có tính oxi hóa mạnh hơn sẽ điện phân trước:
Fe3+ + 1e → Fe2+
Cu2+ + 2e → Cu
2H+ + 2e → H2
Khi ở catot bắt đầu thoát khí thì chứng tỏ Fe3+ và Cu2+ vừa bị điện phân hết
Ở anot:
2Cl- → Cl2 + 2e
Lời giải chi tiết:
Thứ tự điện phân:
Ở catot: ion nào có tính oxi hóa mạnh hơn sẽ điện phân trước:
Fe3++ 1e → Fe2+
0,1 → 0,1 mol
Cu2++ 2e → Cu
0,2→ 0,4 mol 0,2 mol
2H++ 2e → H2
Khi ở catot bắt đầu thoát khí thì chứng tỏ Fe3+ và Cu2+ vừa bị điện phân hết
Tổng số mol e nhận bằng 0,1 + 0,4 = 0,5 mol = Tổng số mol e cho
Ở anot:
2Cl- → Cl2+ 2e
0,25← 0,5 mol
Vậy V = VCl2 = 0,25.22,4 = 5,6 lít
Đáp án A
Câu hỏi 42 :
Điện phân có màng ngăn 500 ml dung dịch chứa hỗn hợp gồm CuCl2 0,1M và NaCl 0,5M (điện cực trơ, hiệu suất điện phân 100%) với cường độ dòng điện 5A trong 3860 giây. Dung dịch thu được sau điện phân có khả năng hoà tan m gam Al. Giá trị lớn nhất của m là
- A 4,05.
- B 2,70.
- C 1,35.
- D 5,40.
Đáp án: B
Phương pháp giải:
Ở catot:
Cu2+ + 2e →Cu
2H2O + 2e →H2+ 2OH-
Ở anot:
2Cl- → Cl2+ 2e
Dung dịch sau điện phân có OH-
Al + OH-+ H2O → AlO2-+ 3/2 H2
Lời giải chi tiết:
Ta có: nCuCl2 = 0,05 mol; nNaCl = 0,25 mol → nCl- = 2.0,05+ 0,25 = 0,35 mol
Ta có: ne = It/F = 0,2 mol
ở catot:
Cu2+ + 2e →Cu
0,05 → 0,1
2H2O + 2e →H2+ 2OH-
0,1 → 0,1 mol
Ở anot:
2Cl- → Cl2+ 2e
0,35
0,2← 0,2 mol
Do ở anot: nCl- pứ = 0,2 mol < 0,35 mol nên Cl- chưa bị điện phân hết
→Nước chưa bị điện phân ở anot
Dung dịch sau điện phân có OH-
Al + OH-+ H2O → AlO2-+ 3/2 H2
Ta có: nAl = nOH- = 0,1 mol → m = 2,7 gam
Đáp án B
Câu hỏi 43 :
Tiến hành điện phân (với điện cực trơ) V lít dung dịch CuCl2 0,5M. Khi dừng điện phân thu được dung dịch X và 1,68 lít khí Cl2 (đktc) duy nhất ở anot. Toàn bộ dung dịch X tác dụng vừa đủ với 12,6 gam Fe. Giá trị của V là:
- A 0,60
- B 0,15
- C 0,45
- D 0,80
Đáp án: A
Phương pháp giải:
Cl- (cực dương)← CuCl2, H2O → Cu2+ (cực âm)
2Cl- → Cl2 + 2e Cu+2+ 2e → Cu
Do ở anot chỉ có khí Cl2 thoát ra nên chưa có sự điện phân của nước. Dung dịch X chứa CuCl2 còn dư.
CuCl2 → Cu + Cl2 (1)
CuCl2 + Fe → FeCl2+ Cu (2)
Lời giải chi tiết:
Cl- (cực dương)← CuCl2, H2O → Cu2+ (cực âm)
2Cl- → Cl2 + 2e Cu+2+ 2e → Cu
Do ở anot chỉ có khí Cl2 thoát ra nên chưa có sự điện phân của nước. Dung dịch X chứa CuCl2 còn dư.
CuCl2 → Cu + Cl2 (1)
CuCl2+ Fe → FeCl2+ Cu (2)
Theo PT (1): nCuCl2 = nCl2 = 1,68/22,4 = 0,075 mol
Theo PT (2): nCuCl2 = nFe = 12,6 : 56 = 0,225 mol
Vậy tổng số mol CuCl2 là: nCuCl2 = 0,075 + 0,225 = 0,3 mol → V = 0,3 : 0,5 = 0,6 lít
Đáp án A
Câu hỏi 44 :
Tiến hành điện phân 100 ml dung dịch Fe(NO3)3 1M và Cu(NO3)2 1M trong bình điện phân với điện cực trơ, I =19,3A, sau một thời gian lấy catot ra cân lại thấy nó nặng thêm 3,584 gam (giả thiết rằng toàn bộ kim loại sinh ra đều bám vào catot). Tính thời gian điện phân?
- A 1060 giây
- B 960 giây
- C 560 giây
- D 500 giây
Đáp án: A
Phương pháp giải:
Thứ tự điện phân:
Ở catot: Ion nào có tính oxi hóa mạnh hơn sẽ điện phân trước:
Fe3++ 1e → Fe2+
Cu2++ 2e → Cu
Khối lượng catot tăng chính là khối lượng kim loại bám vào
Lời giải chi tiết:
Ta có: nFe3+ = 0,1 mol; nCu2+ = 0,1 mol
Thứ tự điện phân:
Ở catot: Ion nào có tính oxi hóa mạnh hơn sẽ điện phân trước:
Fe3++ 1e → Fe2+
0,1 → 0,1 mol
Cu2++ 2e → Cu
Khối lượng catot tăng chính là khối lượng kim loại bám vào
Nếu kim loại sinh ra chỉ có Cu: mCu = 3,584 gam → nCu = 0,056 mol < 0,1 mol (thỏa mãn)
Vậy tổng số mol trao đổi là ne = 0,1+ 2.nCu = 0,1+ 2.0,056 = 0,212 mol
Áp dụng công thức ne = It/F nên suy ra t = 1060 giây
Đáp án A
Câu hỏi 45 :
Điện phân muối nitrat của một kim loại M, đến khi thấy thoát ra 2,24 lít khí (đktc) ở anot thì ở catot có 43,2 g kim loại. Tìm công thức của muối biết không có khí thoát ra ở catot.
- A Cu(NO3)2
- B Mg(NO3)2
- C Fe(NO3)2
- D AgNO3
Đáp án: D
Phương pháp giải:
Khí thoát ra ở anot là O2
Bảo toàn e: n.nM = 4nO2 (với n là số oxi hóa của M)
=> MM = mM : n
Biện luận tìm được kim loại phù hợp.
Lời giải chi tiết:
Khí thoát ra ở anot là O2: nO2 = 0,1 mol
Bảo toàn e: n.nM = 4nO2 (với n là số oxi hóa của M) => nM = 4nO2 : n = 0,4/n (mol)
=> MM = mM : nM = 43,2 : (0,4/n) = 108n
Xét n = 1 → M = 108 → M là Ag
Xét n = 2 → M =216 loại
Xét n = 3→ M = 324 loại
Vậy công thức của muối là AgNO3.
Đáp án D
Câu hỏi 46 :
Điện phân hoàn toàn dung dịch hỗn hợp gồm a mol Cu(NO3)2 và b mol NaCl với điện cực trơ , màng ngăn xốp. Để dung dịch thu được sau khi điện phân có khả năng phản ứng với Al2O3 thì:
- A b = 2a
- B b > 2a
- C b <2a
- D b < 2a hoặc b>2a
Đáp án: D
Lời giải chi tiết:
Dung dịch sau phản ứng phản ứng với Al2O3 nên dung dịch đó chứa axit hoặc bazo kiềm.
Câu hỏi 47 :
Điện phân 200ml dung dịch Y gồm KCl 0,1M và Cu(NO3)2 0,2M với cường độ dòng điện 5A trong thời gian 1158 giây, điện cực trơ, màng ngăn xốp. Giả sử nước bay hơi không đáng kể. Độ giảm khối lượng của dung dịch sau khi điện phân là:
- A 3,59 gam.
- B 2,31 gam.
- C 1,67 gam.
- D 2,95 gam.
Đáp án: D
Phương pháp giải:
Ta có: nKCl = 0,02 mol; nCu(NO3)2 = 0,04 mol
Ta có: ne = It/F = 0,06 mol
Ở catot:
Cu2++ 2e → Cu
Cu2+ chưa bị điện phân hết nên H2O chưa bị điện phân ở catot.
Ở anot:
2Cl- → Cl2+ 2e
2H2O – 4e → O2+ 4H+
Khối lượng dung dịch giảm là: mdd giảm = mCu+ mCl2+ mO2
Lời giải chi tiết:
Ta có: nKCl = 0,02 mol; nCu(NO3)2 = 0,04 mol
Ta có: ne = It/F = 0,06 mol
Ở catot:
Cu2++ 2e → Cu
0,04
0,03← 0,06→ 0,03 mol
Cu2+ chưa bị điện phân hết nên H2O chưa bị điện phân ở catot.
Ở anot:
2Cl- → Cl2+ 2e
0,02 → 0,01 0,02 mol
2H2O – 4e → O2+ 4H+
0,04→ 0,01 mol
Khối lượng dung dịch giảm là: mdd giảm = mCu+ mCl2+ mO2 = 64. 0,03 + 0,01. 71+ 0,01.32 =2,95 gam
Đáp án D
Câu hỏi 48 :
Điện phân 150 ml dd AgNO3 1M với điện cực trơ trong t giờ, cường độ dòng điện không đổi 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dd Y và khí Z. Cho 12,6 gam Fe vào Y, sau khi các phản ứng kết thúc thu được 14,5 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5). Giá trị của t là :
- A 0,8.
- B 1,2.
- C 1,0.
- D 0,3.
Đáp án: C
Phương pháp giải:
2AgNO3+ H2O →2 Ag + 2HNO3 + ½ O2
Khi cho Fe vào Y thu được hỗn hợp kim loại chứng tỏ trong Y có chứa AgNO3 dư
Các phản ứng:
2AgNO3 + H2O → 2Ag + 2HNO3 + ½ O2
3Fe + 2NO3- + 8H+ ® 3Fe2+ + 2NO + 4H2O. (do Fe còn dư).
Fe + 2Ag+ ® 3Fe2+ + 2Ag
Lời giải chi tiết:
Ta có: nAgNO3 = 0,15 mol
2AgNO3+ H2O →2 Ag + 2HNO3 + ½ O2
Khi cho Fe vào Y thu được hỗn hợp kim loại chứng tỏ trong Y có chứa AgNO3 dư
Các phản ứng:
2AgNO3 + H2O → 2Ag + 2HNO3 + ½ O2
x mol x mol
3Fe + 2NO3- + 8H+ ® 3Fe2+ + 2NO + 4H2O. (do Fe còn dư).
0,375x x mol
Fe + 2Ag+ ® 3Fe2+ + 2Ag
0,5y mol y mol y mol
Giải hệ : x + y = 0,15 và 108.y - (0,375x + 0,5y).56 = 14,5 - 12,6 = 1,9
=> x = 0,1 mol.
=> t = (96500. 0,1)/2,68.3600 = 1 (giờ).
Đáp án C
Câu hỏi 49 :
Điện phân 100ml dung dịch Fe2(SO4)3 1M (điện cực trơ, không màng ngăn), với cường độ dòng điện I = 2,68A trong thời gian t giờ thì bắt đầu có khí thoát ra ở catot (hiệu suất của quá trình điện phân là 100%). Giá trị của t là:
- A 4
- B 1
- C 6
- D 2
Đáp án: D
Phương pháp giải:
Thứ tự điện phân tại catot:
(1) Fe3+ + 1e → Fe2+
(2) 2H+ + 2e → H2
(3) Fe2+ + 2e → Fe
Tại anot:
H2O → 2H+ + 0,5 O2 + 2e
Do điện phân không màng ngăn nên H+ bên anot di chuyển sang catot và bị điện phân trước Fe2+ nên sẽ xuất hiện khí H2.
Vậy khi bắt đầu có khí thoát ra tức là phản ứng điện phân (1) vừa xảy ra hết.
Lời giải chi tiết:
Ta có: nFe2(SO4)3 = 0,1 mol => nFe3+ = 0,2 mol
Thứ tự điện phân tại catot:
(1) Fe3+ + 1e → Fe2+
(2) 2H+ + 2e → H2
(3) Fe2+ + 2e → Fe
Tại anot:
H2O → 2H+ + 0,5 O2 + 2e
Do điện phân không màng ngăn nên H+ bên anot di chuyển sang catot và bị điện phân trước Fe2+ nên sẽ xuất hiện khí H2.
Vậy khi bắt đầu có khí thoát ra tức là phản ứng điện phân (1) vừa xảy ra hết.
(1) Fe3+ + 1e → Fe2+
0,2 → 0,2
=> ne = 0,2 mol
=> t = ne.F/I = 0,2.96500/2,68 = 7201 giây = 2 giờ
Đáp án D
Câu hỏi 50 :
Điện phân 100 ml dung dịch hỗn hợp gồm CuSO4 a mol/l và NaCl 2M (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) với cường độ dòng điện không đổi 1,25A trong 193 phút. Dung dịch sau điện phân có khối lượng giảm 9,195 gam so với dung dịch ban đầu. Giá trị của a là:
- A 0,40
- B 0,50
- C 0,45
- D 0,60
Đáp án: D
Phương pháp giải:
Ta có: ne = It/F
Dựa vào số mol e trao đổi chứng minh tại catot nước bị điện phân
Nên mdung dịch giảm = mCu+ mH2+ mCl2
Vận dụng định luật bảo toàn electron ta tìm được nCu → nCuSO4 → CM của CuSO4
Lời giải chi tiết:
Ta có: nNaCl = 0,2 mol
Ta có: ne = \(\frac{{It}}{F} = \frac{{1,25.193.60}}{{96500}}\) = 0,15 mol
Tại anot:
2Cl- → Cl2 + 2e
0,075← 0,15 mol
Tại catot:
Nếu H2O chưa bị điện phân thì nCu = 0,075 mol
→ m dung dịch giảm = mCu+ mCl2 = 0,075.64 + 0,075.71 = 10,125 > 9,195 → Phải có nước bị điện phân ở catot
Cu2++ 2e → Cu
2H2O + 2e → H2+ 2OH-
Đặt nCu = x mol; nH2 = y mol
Ta có: ne nhận = 2x + 2y = 0,15 mol
Mặt khác, mdung dịch giảm = 64x + 2y + 0,075.71 = 9,195
Giải hệ trên ta có x = 0,06 và y = 0,015
→ a = x/0,1 = 0,6M
Đáp án D
