Câu hỏi 1 :
Khi cho xenlulozo phản ứng hoàn toàn với anhiđric axetic (CH3CO)2O thu được 18 gam CH3COOH và 33,66 gam hỗn hợp X gồm a mol xenlulozo triaxetat và b mol xenlulozo điaxetat. Tỉ lệ a : b trong x là
- A 4 : 9.
- B 3 : 2.
- C 4 : 7.
- D 2 : 3.
Đáp án: A
Phương pháp giải:
+ Bảo toàn khối lượng
+ n(CH3CO)2O = 3n xenlulozơ trinitrat + 2n xenlulozơ đinitrat
Lời giải chi tiết:
nCH3CHOOH = 18 : 60 = 0,3 (mol)
C6H7O2(OH)3 + 3(CH3CO)2O → C6H7O2(OCOCH3)3 + 3CH3COOH
a → 3a
C6H7O2(OH)3 + 2(CH3CO)2O → C6H7O2(OCOCH3)2(OH) + 2CH3COOH
b → 2b
Ta có:
\(\left\{ \begin{array}{l}{n_{C{H_3}{\rm{COO}}H}} = 3a + 2b = 0,3\\{m_X} = 288a + 246b = 33,66\end{array} \right. \Rightarrow \left\{ {\begin{array}{*{20}{c}}{a = 0,04(mol)}\\{b = 0,09(mol)}\end{array} \Rightarrow a:b = 4:9} \right.\)
Đáp án A
Câu hỏi 2 :
Xenlulozo trinitrat được điều chế từ phản ứng giữa axit nitric với xenlulozo
Hiệu suất 60% tính theo xenlulozo. Nếu dùng 1 tấn xenlulozo thì khối lượng Xenlulozo trinitrat điều chế được là
- A 1,485 tấn.
- B 1,10 tấn.
- C 1,835 tấn.
- D 0,55 tấn.
Đáp án: B
Phương pháp giải:
+ Viết PTHH
+ nxenlulozo trinitrat = n xenlulozo
+ \(H\%{\text{ }} = \frac{{{m_{li\,thuyet}}}}{{m{\,_{thuc\,te}}}}.100\% \)
Lời giải chi tiết:
[C6H7O2(OH)3]n + 3nHNO3 \(\overset{t^o,xt}{\rightarrow}\) [C6H7O2(ONO2)3]n + 3nH2O
n xenlulozo = n Xenlulozo trinitrat
=> m Xenlulozo trinitrat = \(\frac{{1\,.\,0,6\,.\,297}}{{162}}\) = 1,1 tấn
Đáp án B
Câu hỏi 3 :
Tính thể tích dung dịch HNO3 67,5% (khối lượng riêng D = 1,5 g/ml) và khối lượng xenlulozơ cần dùng để điều chế được 22,275 kg xenlulozơ trinitrat? (Biết hiệu suất phản ứng đạt 75%)
- A 14 lít và 16,2 kg.
- B 18,67 lít và 12,15 kg.
- C 14 lít và 9,12 kg.
- D 18,67 lít và 16,2 kg.
Đáp án: D
Phương pháp giải:
+ Viết PTHH: C6H10O5 + 3HNO3 → C6H7O2(NO3)3 + 3H2O
+ Tính toán theo PTHH,coi giá trị n = 1 để thuận tiện cho việc tính toán
Lời giải chi tiết:
nxenlulozo trinitrat = 22,275/297 = 0,075 kmol
C6H10O5 + 3HNO3 → C6H7O2(NO3)3 + 3H2O
- Tính lượng HNO3:
Từ PTHH => nHNO3 = 3.nxenlulozo trinitrat = 0,225 kmol
mHNO3 = 0,225.63 = 14,175 kg
m dd HNO3 = 14,175.(100/67,5) = 21 kg
V dd HNO3 = m / D = 21 / 1,5 = 14 lít
Do hiệu suất của phản ứng là H% = 75% nên lượng HNO3 cần dùng phải nhiều hơn so với lượng tính toán:
V dd HNO3 cần dùng = 14.(100/75) = 18,67 lít
- Tính lượng tinh bột:
Từ PTHH => nC6H10O5 = nxenlulozo trinitrat = 0,075 mol
=> m tinh bột = 0,075.162 = 12,15 kg
Do hiệu suất của phản ứng là H% = 75% nên lượng tinh bột cần dùng phải nhiều hơn so với lượng tính toán:
m tinh bột cần dùng = 12,15.(100/75) = 16,2 kg
Đáp án D
Câu hỏi 4 :
Từ 2 tấn xenlulozơ với lượng HNO3 đặc lấy dư (xt H2SO4 đặc) người ta sản xuất được 2,97 tấn xenlulozơ trinitrat. Vậy hiệu suất phản ứng là
- A 84%
- B 75%
- C 81%
- D 90%
Đáp án: C
Phương pháp giải:
Bài toán hiệu suất : mThực = mLT.H%
Lời giải chi tiết:
C6H7O2(OH)3 + 3HNO3 -> C6H7O2(NO3)3 + 3H2O
0,01 <- 0,01 tấn mol
=> mXenlulozo(Thực) = 1,62 tấn
=> H% = 81%
Đáp án C
Câu hỏi 5 :
Xenlulozơ trinitrat được điều chế từ xenlulozơ và axit nitric đặc có xúc tác axit sunfuric đặc, nóng. Để có 23,76 kg xenlulozơ trinitrat, cần dùng dung dịch chứa m kg axit nitric (hiệu suất phản ứng đạt 90%). Giá trị của m là
- A 16,8 kg.
- B 30 kg.
- C 21 kg.
- D 10 kg.
Đáp án: A
Phương pháp giải:
Tính theo PTHH: C6H7O2(OH)3 + 3HNO3 → C6H7O2(NO3)3 + 3H2O
Lời giải chi tiết:
nxenlulozo trinitrat = 23,76/297 = 0,08 kmol
PTHH: C6H7O2(OH)3 + 3HNO3 → C6H7O2(NO3)3 + 3H2O
PT: 0,24 kmol ← 0,08 kmol
mHNO3 = 0,24.63 = 15,12 kg
Do phản ứng có hiệu suất nên lượng HNO3 cần dùng lớn hơn lượng tính toán:
=> mHNO3 cần dùng = 15,12.(100/90) = 16,8 kg
Đáp án A
Câu hỏi 6 :
Xenlulozơ trinitrat là chất dễ cháy, nổ mạnh. Muốn điều chế 29,7 kg xenlulozơ trinitrat từ xenlulozơ và axit nitric với hiệu suất 90% thì thể tích HNO3 96% (D = 1,52 g/ml) cần dùng là
- A 24,390 lít
- B 1,439 lít
- C 14,390 lít
- D 15,000 lít
Đáp án: C
Phương pháp giải:
+ Viết PTHH: C6H10O5 + 3HNO3 → C6H7O2(ONO2)3
+ Tính theo PTHH
Lời giải chi tiết:
nXenlulozơ trinitrat = 29,7/297 = 0,1 (kmol)
PTHH: C6H10O5 + 3HNO3 → C6H7O2(ONO2)3
Theo PTHH => nHNO3 = 3nXenlulozơ trinitrat = 0,3 (kmol)
=> mHNO3 = 0,3.63 = 18,9 kg
=> m dd HNO3 = 18,9.(100/96) = 19,6875 (kg)
=> V dd HNO3 = m/D = 19,6875/1,52 = 12,9523 (lít)
Do hiệu suất của phản ứng là 90% nên lượng HNO3 cần dùng phải nhiều hơn lượng tính toán:
=> V dd HNO3 cần dùng = 12,9523.(100/90) = 14,39 lít
Đáp án C
Câu hỏi 7 :
Khối lượng phân tử trung bình của xenlulozơ trong sợi bông là 4860000 (u). Vậy số mắt xích glucozơ có trong xenlulozơ nêu trên là
- A 30000.
- B 27000.
- C 35000.
- D 25000
Đáp án: A
Phương pháp giải:
Khối lượng 1 mắt xích là 162u → số mắt xích
Lời giải chi tiết:
Hướng dẫn giải :
Số mắt xích glucozo có trong xenlulozo là : 4860000 : 162 = 30000
Đáp án A
Câu hỏi 8 :
Xenlulozơ trinitrat là chất dễ cháy và nổ mạnh được điều chế từ xenlulozơ và HNO3. Muốn điều chế 29,7 kg Xenlulozơ trinitrat (hiệu suất 90%) thì thể tích HNO3 96%( d=1,52 g/ml) cần dùng là
- A 1,439 lít.
- B 14,39 lít.
- C 24,39 lít.
- D 15 lít.
Đáp án: B
Phương pháp giải:
Phương pháp :
PTHH : C6H7O2(OH)3 + 3 HNO3→ C6H7O2(NO3)3 + 3 H2O
Số mol sản phẩm là số mol thực tế thu được
Lời giải chi tiết:
Hướng dẫn Giải :
n C6H7O2(NO3)3 = 0,1 k.mol => n HNO3 = 0,3 k.mol
=> n lý thuyết = 0,3 : 90 . 100 = k.mol => m HNO3 = 21 g
=> m dd HNO3 = 21 : 96 . 100 = 21,875 k.g
=> V dd HNO3 = 21,875 : 1,52 = 14,39 k.ml = 14,39 lít
Đáp án B
Câu hỏi 9 :
Thể tích dung dịch HNO3 67,5% (khối lượng riêng là 1,5 g/ml) cần dùng để tác dụng với xenlulozơ tạo thành 178,2 kg xenlulozơ trinitrat là (biết lượng HNO3 bị hao hụt là 20%)
- A 98 lít.
- B 140 lít.
- C 162 lít.
- D 110 lít.
Đáp án: B
Phương pháp giải:
Để tạo ra 1 mol xenlulozo trinitrat cần 3 mol HNO3 nên ta tính được khối lượng HNO3 phản ứng theo lý thuyết
Sau đấy tính khối lượng HNO3 thực tế do H=80%
Lời giải chi tiết:
Xét phản ứng của 1 mắt xích xenlulozo.
\({C_6}{H_7}{O_2}{(OH)_3} + 3HN{O_3} \to {C_6}{H_7}{O_2}{({\text{ON}}{{\text{O}}_2})_3}(TNX) + 3{H_2}O\)
nTNX = 178,2 : 297 = 0,6 kmol
Theo PTHH: nHNO3 = 3nTNX = 1,8 kmol => mHNO3 = 1,8.63 = 113,4 kg
=> m dd HNO3 = \(113,4.\frac{{100}}{{67,5}}\) = 168 kg
=> \({V_{dd{\text{ }}HN{O_3}}} = \frac{{{m_{dd\,HN{O_3}}}}}{D} = \frac{{168}}{{1,5}} = 112\,\,(l)\)
Nhưng do hao hụt của quá trình sản xuất là 20% nên hiệu suất chỉ đạt 80%. Thể tích HNO3 thực tế đã dùng là:
V dd HNO3 (tt) = 112.(100/80) = 140 lít
Đáp án B
Câu hỏi 10 :
Xenlulozo trinitrat được điều chế giữa axit nitric với xenlulozo (hiệu suất phản ứng là 60% tính theo xenlulozo). Nếu dùng 2 tấn xenlulozo thì khối lượng xenlulozo trinitrat điều chế được là:
- A 2,97 tấn
- B 3,67 tấn
- C 1,1 tấn
- D 2,2 tấn
Đáp án: D
Phương pháp giải:
Xenlulozơ + axitnitrit à xenlulozơ trinitrat
[C6H7O2(OH)3]n + 3nHNO3 à [C6H7O2(ONO2)3]n + 3nH2O
162n 3n.63 297n
Lời giải chi tiết:
[C6H7O2(OH)3]n + 3nHNO3 à [C6H7O2(ONO2)3]n + 3nH2O
162n 297n
(tấn) 2 => 3,67.0,6 = 2,2
Đáp án D
Câu hỏi 11 :
Xenlulozơ trinitrat được điều chế từ xenlulozơ và axit nitric đậm đặc có H2SO4 đặc, nóng xúc tác. Để có 29,7 kg xenlulozơ trinitrat cần dùng dung dịch chứa m kg axit nitric, hiệu suất phản ứng đạt 90%. Giá trị của m là
- A 42 kg.
- B 21 kg.
- C 30 kg.
- D 10 kg.
Đáp án: B
Phương pháp giải:
Tính toán theo PTHH : C6H7O2(OH)3 + 3 HNO3→ C6H7O2(NO3)3 + 3 H2O
\(H\% = \frac{{{n_{tt}}}}{{{n_{lt}}}}.100\% \), số mol sản phẩm là số mol thực tế thu được => tính ra số mol lý thuyết
Lời giải chi tiết:
n xenlulozơ trinitrat = 29,7 : 297 = 0,1 k . mol
Theo PTHH => n HNO3 = 0,3 mol
\(H\% = \frac{{{n_{tt}}}}{{{n_{lt}}}}.100\% \)=>\(90\% = \frac{{0,3}}{{{n_{lt}}}}.100\% \) => n Lý thuyết = 1/3 k. mol
=> m HNO3 = 1/3 . 63 = 21 kg
Đáp án B
Câu hỏi 12 :
Xenlulozơ trinitrat được điều chế từ xenlulozơ và axit nitric đặc có xúc tác axit sunfuric đặc, nóng. Để có 89,1 kg xenlulozơ trinitrat, cần dùng dung dịch chứa m kg axit nitric (hiệu suất phản ứng đạt 90%). Giá trị của m là
- A 51,03.
- B 56,7.
- C 60.
- D 63.
Đáp án: D
Phương pháp giải:
Tính theo PTHH: C6H7O2(OH)3 + 3HO-NO2 → C6H7O2(O-NO2)3 + 3H2O
Lời giải chi tiết:
PTHH: C6H7O2(OH)3 + 3HO-NO2 → C6H7O2(O-NO2)3 + 3H2O
3.63 (kg) 297 kg
56,7 kg ← 89,1 kg
Do hiệu suất đạt 90% nên lượng HNO3 đã dùng là: 56,7.100/90 = 63 kg
Đáp án D
Câu hỏi 13 :
Xenlulozơ trinitrat được điều chế từ xenlulozơ và axit nitric đặc có xúc tác là axit sunfuric đặc, đun nóng. Để có 59,4 kg xenlulozơ trinitrat cần dung dịch chứa m kg axit nitric (hiệu suất 90%). Giá trị của m là
- A 42,0.
- B 30,0.
- C 14,0.
- D 37,8.
Đáp án: A
Phương pháp giải:
Tính theo PTHH: C6H7O2(OH)3 + 3HNO3 \(\xrightarrow{{{H_2}S{O_4}dac,{t^0}}}\) C6H7O2(ONO2)3 + 3H2O
\(\% H = \frac{{{m_{HN{O_3}}}{\,_{li\,thuyet}}}}{{{m_{HN{O_3}}}{\,_{thuc\,te}}}}.100\% \) với lượng HNO3 lí thuyết là tính theo PTHH
Lời giải chi tiết:
PTHH: C6H7O2(OH)3 + 3HNO3 \(\xrightarrow{{{H_2}S{O_4}dac,{t^0}}}\) C6H7O2(ONO2)3 + 3H2O
Theo PT: 186 → 297 (kg)
Theo ĐB: x =? ← 59,4 (kg)
→ mHNO3 lí thuyết =\(\frac{{59,4 \times 186}}{{297}} = 37,8(kg)\)
Vì %H= 90% nên → mHNO3 thực tế = \(\frac{{{m_{HN{O_{3\,}}}}li\,thuyet}}{{\% H}} \times 100\% = \frac{{37,8}}{{90\% }} \times 100\% = 42(kg)\)
Đáp án A
Câu hỏi 14 :
Cho xenlulozơ tác dụng với anhiđrit axetic, người ta thu được axit axetic và 82,2 g hỗn hợp rắn gồm xenlulozơ triaxetat và xenlulozơ điaxetat. Để trung hoà 1/10 lượng axit tạo ra cần dùng 80 ml dung dịch NaOH 1M. Phần trăm khối lượng của xenlulozơ triaxetat và xenlulozơ điaxetat trong hỗn hợp rắn thu được lần lượt là
- A 70,1% và 29,9%.
- B 71,0% và 29,0%.
- C 80% và 20%.
- D 40% và 60%.
Đáp án: A
Phương pháp giải:
- Viết phương trình hóa học
- Tính số mol NaOH => số mol CH3COOH
- Lập hệ phương trình tính khối lượng xenlulozơ triaxetat và xenlulozơ điaxetat
- Tính % khối lượng từng chất
Lời giải chi tiết:
- Các PTHH:
\({{\text{[}}{C_6}{H_7}{O_2}{(OH)_3}{\text{]}}_n} + 3n{(C{H_3}CO)_2}O \to {{\text{[}}{C_6}{H_7}{O_2}{{\text{(OOCC}}{{\text{H}}_3})}_3{\text{]}}_n} + 3nC{H_3}{\text{COO}}H\)
\({{\text{[}}{C_6}{H_7}{O_2}{(OH)_3}{\text{]}}_n} + 2n{(C{H_3}CO)_2}O \to {{\text{[}}{C_6}{H_7}{O_2}{OH}{{{\text{(OOCC}}{{\text{H}}_3})}}_2{\text{]}}_n} + 2nC{H_3}{\text{COO}}H\)
- Để trung hoà 1/10 lượng axit cần 0,08 mol NaOH:
\(C{H_3}{\text{COO}}H + NaOH \to C{H_3}{\text{COONa + }}{{\text{H}}_2}O\)
→ nCH3COOH (1/10 X) = nNaOH = 0,08 (mol).
→ nCH3COOH (X) = 10.0,08 = 0,8 (mol).
Đặt khối lượng xenlulozơ triaxetat là x gam, khối lượng xenlulozơ điaxetat là y gam.
Ta có: x + y = 82,2 (1)
Khi tạo ra 288n g xenlulozơ triaxetat, thì tạo ra 3n mol CH3COOH
Khi tạo ra x g xenlulozơ triaxetat, thì tạo ra \(\dfrac{3x}{288}\) mol CH3COOH
Khi tạo ra 246n g xenlulozơ điaxetat thì tạo ra 2n mol CH3COOH
Khi tạo ra y g xenlulozơ điaxetat thì tạo ra \(\dfrac{2y}{246}\) mol CH3COOH.
=> \({n_{C{H_3}{\text{COO}}H}} = \dfrac{3x}{288}\) + \(\dfrac{2y}{246}\) = 0,8 (2)
Giải hệ gồm phương trình (1) và (2) tìm được: x = 57,6; y = 24,6.
Xenlulozơ triaxetat chiếm \(\frac{{57,6}}{{82,2}}.100\% =70,1\%\) khối lượng.
Xenlulozơ điaxetat chiếm 100% - 70,1% = 29,9% khối lượng.
Đáp án A
Câu hỏi 15 :
Thể tích dung dịch HNO3 67,5% (khối lượng riêng là 1,5 g/ml) cần dùng để tác dụng với xenlulozơ tạo thành 89,1 kg xenlulozơ trinitrat là (biết lượng HNO3 bị hao hụt là 30%)
- A 55 lít.
- B 80 lít.
- C 49 lít.
- D 70 lít.
Đáp án: B
Phương pháp giải:
- Tính toán theo PTHH: [C6H7O2(OH)3]n + 3n HNO3 đặc → [C6H7O2(ONO2)3]n + 3nH2O
- Lưu ý, lượng HNO3 hao hụt là 30% tức là hiệu suất là 70% nên:
Vdd HNO3 cần dùng = V theo PT.(100/70)
Lời giải chi tiết:
PTHH: [C6H7O2(OH)3]n + 3n HNO3 đặc → [C6H7O2(ONO2)3]n + 3nH2O
Ta có: nxelulozo trinitrat = 89,1 : (297n) = 0,3/n (kmol)
Theo PTHH ta có: nHNO3 = 0,9 kmol → mHNO3 = 0,9 . 63 = 56,7 kg
→ mdd HNO3 = 56,7.100 : 67,5 = 84 (kg)
→ Vdd HNO3 = 84 : 1,5 = 56 (lít)
Do lượng HNO3 bị hao hụt là 30% tức là hiệu suất phản ứng đạt 70% nên thể tích dung dịch HNO3 67,5% thực tế cần dùng là:
Vthực tế = 56.(100/70) = 80 (lít)
Đáp án B
Câu hỏi 16 :
Tính thể tích dung dịch axit nitric 63% (D = 1,4 g/ml) cần dùng vừa đủ để sản xuất được 59,4 kg xenlulozo trinitrat (hiệu suất 80%). Viết phương trình hóa học xảy ra.
Phương pháp giải:
- Tính số mol xenlulozo trinitrat
- Viết PTHH: [C6H7O2(OH)3]n + 3nHNO3 \(\xrightarrow{{{H_2}S{O_4}dac,{t^o}}}\) [C6H7O2(ONO2)3]n + 3nH2O
- Theo PTHH: \({n_{HN{O_3}}} = 3n.{n_{xenlulozo\,trinit{\rm{r}}at}}\)→ \({m_{HN{O_3}}}\)→ \({m_{dd\,HN{O_3}}}\)→ \({V_{dd}}{\,_{HN{O_3}}} = \frac{m}{D}\)
Chú ý: Phản ứng có hiệu suất.
Lời giải chi tiết:
Ta có: \({n_{xenlulozo\,\,trinit{\rm{r}}at}} = \frac{{59,4}}{{297n}} = \frac{{0,2}}{n}(kmol)\)
PTHH: [C6H7O2(OH)3]n + 3nHNO3 \(\xrightarrow{{{H_2}S{O_4}dac,{t^o}}}\) [C6H7O2(ONO2)3]n + 3nH2O
Theo PTHH: \({n_{HN{O_3}}} = 3n.{n_{xenlulozo\,trinit{\rm{r}}at}} = 3n.\frac{{0,2}}{n} = 0,6(kmol)\)
→ \({m_{HN{O_3}}} = 0,6.63 = 37,8(kg)\)
→ \({m_{dd\,HN{O_3}}} = 37,8.\frac{{100}}{{63}} = 60(kg)\)
→ \({V_{dd}}{\,_{HN{O_3}}} = \frac{m}{D} = \frac{{60}}{{1,4}} = 42,857(l)\)
Do hiệu suất cả quá trình là 80% nên thể tích dung dịch HNO3 cần dùng là:
\({V_{dd}}{\,_{HN{O_3}\,can\,dung}} = 42,857.\frac{{100}}{{80}} = 53,57(l)\)
Câu hỏi 17 :
Tiến hành sản xuất ancol etylic từ xenllulozơ với hiệu suất của toàn bộ quá trình là 70%. Để sản xuất 2 tấn ancol etylic, khối lượng xenlulozơ cần dùng là
- A 5,031 tấn.
- B 10,062 tấn.
- C 3,521 tấn.
- D 2,515 tấn.
Đáp án: A
Phương pháp giải:
Sơ đồ: (C6H10O5)n → 2nC2H5OH
Tính lượng (C6H10O5)n lí thuyết cần dùng theo sơ đồ (dựa vào số mol ancol)
Vì %H = 70% nên lượng xenlulozơ cần dùng phải nhiều hơn lượng lí thuyết cần dùng để
⟹ m(C6H10O5)n thực tế = m(C6H10O5)n lí thuyết × 100% : % H = ?
Lời giải chi tiết:
Sơ đồ: (C6H10O5)n → 2nC2H5OH
nC2H5OH = mC2H5OH : MC2H5OH = 2 : 46 = 1/23 (tấn mol)
Theo sơ đồ: n(C6H10O5)n = 1/2 nC2H5OH = 1/2 × 1/23 = 1/46 (tấn mol)
m(C6H10O5)n lí thuyết = n(C6H10O5)n × M(C6H10O5)n = 1/46 × 162 = 81/23 (tấn)
Vì %H = 70% nên lượng xenlulozơ cần dùng phải nhiều hơn lượng lí thuyết cần dùng để
⟹ m(C6H10O5)n thực tế = m(C6H10O5)n lí thuyết × 100% : % H = 81/23 × 100% : 70% ≈ 5,031 (tấn)
Đáp án A
Câu hỏi 18 :
Để điều chế 26,73 kg xenlulozơ trinitrat (hiệu suất 60%) cần dùng ít nhất V lít axit nitric 94,5% (D=1,5 g/ml) phản ứng với xenlulozơ dư. Giá trị của V là
- A 20
- B 18
- C 30
- D 12
Đáp án: A
Phương pháp giải:
+ Viết PTHH: C6H10O5 + 3HNO3 → C6H7O2(NO3)3 + 3H2O
+ Tính toán theo PTHH, bỏ qua giá trị n để thuận tiện cho việc tính toán
Lời giải chi tiết:
C6H10O5 + 3HNO3 → C6H7O2(NO3)3 + 3H2O
nxenlulozo trinitrat = 26,73/297 = 0,09 kmol
Từ PTHH => nHNO3 = 3.nxenlulozo trinitrat = 0,27 kmol
mHNO3 = 0,27.63 = 17,01 kg
m dd HNO3 = 17,01.(100/94,5) = 18 kg
V dd HNO3 = m / D = 18 / 1,5 = 12 lít
Do hiệu suất của phản ứng là H% = 60% nên lượng HNO3 cần dùng phải nhiều hơn so với lượng tính toán:
V dd HNO3 cần dùng = 12.(100/60) = 20 lít
Đáp án A
Câu hỏi 19 :
Từ 16,20 tấn xenlulozơ người ta sản xuất được m tấn xenlulozơ trinitrat (biết hiệu suất phản ứng tính theo xenlulozơ là 90%). Giá trị của m là
- A 29,70.
- B 26,73.
- C 33,00.
- D 25,46.
Đáp án: B
Phương pháp giải:
Phương pháp :
Viết sơ đồ tạo xenlulozơ trinitrat để tính lượng polime theo lý thuyết
Hiệu suất phản ứng là 90% nên m= mlt . 90 :100
Lời giải chi tiết:
Lời giải
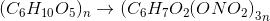
16,2 tấn → 16,2 : 162.297.0,9 =26,73 mol
Đáp án B
Câu hỏi 20 :
Từ 32,4 tấn mùn cưa (chứa 50% xenlulozơ) người ta sản xuất được m tấn thuốc súng không khói (xenlulozơ trinitrat) với hiệu suất phản ứng tính theo xenlulozơ là 90%. Giá trị của m là
- A 26,73.
- B 29,70.
- C 33,00.
- D 25,46.
Đáp án: A
Phương pháp giải:
Viết PTHH và tính toán theo PTHH:
C6H7O2(OH)3 + 3HO-NO2 → C6H7O2(ONO2)3 + 3H2O
Lời giải chi tiết:
m xenlulozo = 32,4.50% = 16,2 tấn
C6H7O2(OH)3 + 3HO-NO2 → C6H7O2(ONO2)3 + 3H2O
162 297
16,2 → 29,7 (tấn)
Do hiệu suất đạt 90% nên khối lượng thuốc súng thu được thực tế là: 29,7.90% = 26,73 tấn
Đáp án A
