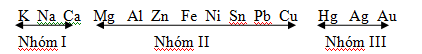ĐỀ CƯƠNG ÔN TẬP HỌC KÌ I
CHƯƠNG I: SỰ ĐIỆN LI
1. Sự điện li
- Sự điện li là quá trình phân li của các chất ra ion.
Ví dụ: HCl → H+ + Cl-
- Phân loại chất điện li:
+) Chất điện li mạnh là chất khi tan trong nước, tất cả phân tử hòa tan đều phân li ra ion.
Trong phương trình điện li, dùng mũi tên 1 chiều.
Chú ý: Các chất điện li mạnh thường là: Axit mạnh (HCl, HNO3, H2SO4, HClO4…), bazơ mạnh (NaOH, (BaOH)2, KOH, Ca(OH)2,..) và hầu hết muối tan
Ví dụ: NaOH → Na+ + OH-
+) Chất điện li yếu là chất khi tan trong nước chỉ có 1 phần số phân tử hòa tan phân li ra ion.
Trong phương trình điện li, dùng mũi tên 2 chiều
Chú ý: Các chất điện li yếu thường là: Axit yếu, bazơ yếu và muối không tan.
Ví dụ: HCOOH \(\rightleftarrows \) H+ + HCOO-
2. Axit, bazơ
a) Theo thuyết A-rê-ni-ut
- Axit là chất khi tan trong nước phân li ra cation H+. Ví dụ: HCl, H2SO4,…
- Bazơ là chất khi tan trong nước phân li ra anion OH-. Ví dụ: NaOH, Ba(OH)2,…
- Hiđroxit lưỡng tính là hiđroxit khi tan trong nước vừa có thể phân li như axit vừa có thể phân li như bazơ.
Ví dụ: Zn(OH)2 \(\rightleftarrows \) Zn2+ + 2OH- : phân li kiểu bazơ
Zn(OH)2 \(\rightleftarrows \) ZnO2- + 2H+ : phân li kiểu axit
b) Theo thuyết Bron-stêt
- Axit là chất (phân tử, ion) khi tan trong nước phân li ra cation H+ (proton).
- Bazơ là chất (phân tử, ion) nhận proton.
- Chất lưỡng tính là chất (phân tử, ion) vừa có thể nhường proton, vừa có thể nhận proton.
- Chất trung tính là chất không thể nhường hoặc nhận proton.
3. Muối
a) Định nghĩa: Muối là hợp chất khi tan trong nước phân li ra cation kim loại (hoặc NH4+) và anion gốc axit.
b) Phân loại
- Muối trung hòa là muối mà anion gốc axit không còn hiđro có khả năng phân li ra ion H+
- Muối axit là muối mà anion gốc axit vẫn còn hiđro có khả năng phản li ra ion H+
4. Tích số ion của nước. pH và môi trường của dung dịch
a) Tích số ion của nước
Ở 25oC: \({{K}_{{{H}_{2}}O}}=[{{\text{H}}^{+}}].[O{{H}^{-}}]={{10}^{-14}}\)
b) pH của dung dịch
Để đánh giá độ axit và độ kiềm của dung dịch, người ta dùng pH với quy ước: [H+] = 10-pH hay pH = -log[H+]
- Môi trường axit: pH < 7
- Môi trường trung tính: pH = 7
- Môi trường bazơ: pH > 7
Thang pH thường dùng có giá trị từ 1 đến 14
***- Các dung dịch có pH< 7 ngoài dung dịch axit còn có muối tạo từ kim loại yếu và gốc axit mạnh ví dụ: FeCl2; CuSO4….
- Các dung dịch có pH >7 ngoài dung dịch bazơ còn có muối tạo từ kim loại mạnh và gốc axit yếu ví dụ: HCOONa; K2CO3…
- Các dung dịch có pH = 7 ngoài nước còn có muối tạo từ axit mạnh và bazơ mạnh ví dụ: NaCl, K2SO4,..
5. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Phản ứng trao dổi ion trong dung dịch các chất diện li chỉ xảy ra khi thỏa mãn một trong các điều kiện sau:
+ tạo thành chất kết tủa
+ tạo thành chất khí
+ tạo thành chất điện li yếu
CHƯƠNG 2: NITO – PHOTPHO
A. NITƠ
- Cấu hình electron N (Z = 7): 1s22s22p3
=> Vị trí ô thứ 7, chu kì 2 nhóm VA trong bảng tuần hoàn.
- Số oxi hóa có thể có : -3; 0; +1; +2; +3; +4; +5
1. Cấu tạo và tính chất:
- Cấu tạo: N≡N → N2 rất bền
- Ở điều kiện thường N2 là chất khí không màu, không mùi, không vị, không duy trì sự cháy, sự hô hấp.
- Nhiệt độ thường, N2 khá trơ về mặt hóa học.
- Nhiệt độ cao, N2 vừa thể hiện tính oxi hóa vừa thể hiện tính khử.
+ Tính oxi hóa:
\(\overset{0}{\mathop{{{N}_{2}}}}\,+3Mg\xrightarrow{{{t}^{0}}}M{{g}_{3}}\overset{-3}{\mathop{{{N}_{2}}}}\,\)
+ Tính khử:
\(\overset{0}{\mathop{{{N}_{2}}}}\,+{{O}_{2}}\xrightarrow{{{t}^{0}},xt}2\overset{+2}{\mathop{N}}\,O\)
2. Điều chế:
- Trong công nghiệp: chưng cất phân đoạn không khí lỏng.
- Trong PTN: NH4Cl + NaNO2 \(\xrightarrow{{{t}^{0}}}\) NaCl + N2↑+ 2H2O
B. AMONIAC (NH3)
1. Tính chất vật lý:
- Chất khí không màu, có mùi khai và sốc, nhẹ hơn không khí
- Tan rất nhiều trong nước tạo thành dung dịch NH3 không thu bằng phương pháp dời chỗ của nước.
2. Tính chất hóa học:
- Tính bazơ yếu:
NH3 + H2O \(\rightleftarrows \) NH4+ +OH- (NH3 làm quỳ ẩm chuyển sang màu xanh)
NH3(k) + HCl(k) → NH4Cl(r)
3NH3 + 3H2O + AlCl3 → 3NH4Cl + Al(OH)3
- Tính khử:
\(2\overset{-3}{\mathop{\text{ }N}}\,{{H}_{3}}+3C{{l}_{2}}\to \overset{0}{\mathop{{{N}_{2}}}}\,+6HCl\)
\(2\overset{-3}{\mathop{\text{ }N}}\,{{H}_{3}}+3CuO\to \overset{0}{\mathop{{{N}_{2}}}}\,+3{{H}_{2}}O+3Cu\)
4. Điều chế:
Cho muối amoni tác dụng với dung dịch bazơ
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3↑ + 2H2O
C. MUỐI AMONI (NH4Cl, NH4NO3, (NH4)2SO4…)
- Tác dụng với dung dịch kiềm
NH4+ + OH- → NH3 + H2O (phản ứng này dùng để nhận biết ion NH4+ )
- Phản ứng nhiệt phân: Các muối amoni dễ bị nhiệt phân
+) Muối amoni mà gốc axit không còn khả năng oxi hóa nhiệt phân tạo NH3 :
(NH4)2CO3 \(\xrightarrow{{{t}^{0}}}\) 2NH3 + CO2 + H2O
+) Muối amoni mà gốc axit có khả năng oxi hóa nhiệt phân tạo N2 hoặc N2O:
\(\overset{-3}{\mathop{N}}\,{{H}_{4}}N{{O}_{2}}\xrightarrow{{{t}^{0}}}\overset{0}{\mathop{{{N}_{2}}}}\,+2{{H}_{2}}O\)
\(\overset{-3}{\mathop{N}}\,{{H}_{4}}N{{O}_{3}}\xrightarrow{{{t}^{0}}}\overset{+1}{\mathop{{{N}_{2}}}}\,O+2{{H}_{2}}O\)
D. AXIT NITRIC (HNO3)
1. Tính axit mạnh:
- Làm đỏ quỳ tím.
- Tác dụng với bazơ, oxit bazơ, muối
2. Tính oxi hóa mạnh: HNO3 oxi hóa hầu hết các kim loại kể cả những kim loại đứng sau H như Cu, Ag (trừ Pt, Au), oxi hóa kim loại lên số oxi hóa dương cao nhất, oxi hóa nhiều phi kim và hợp chất.
Sản phẩm khử: thông thường là NO ngoài ra còn có thể là \(N{O_2}\), N2, N2O, (NH4NO3)
\(\overset{0}{\mathop{Cu}}\,\) + 4HNO3(đặc) → \(\overset{+2}{\mathop{Cu}}\,{{\left( N{{O}_{3}} \right)}_{2}}\) + 2NO2↑ + 2H2O
\(\overset{0}{\mathop{Fe}}\,\text{ }\) + 4HNO3(loãng) →\(\overset{+3}{\mathop{Fe}}\,{{(N{{O}_{3}})}_{3}}\) + NO↑ + 2H2O
* Fe, Al, Cr thụ động với HNO3 đặc, nguội.
3. Điều chế:
- Trong PTN:
NaNO3(tinh thể) + H2SO4(đặc) → NaHSO4 + HNO3
- Trong công nghiệp:
\(N{{H}_{3}}\xrightarrow{+{{O}_{2}}}NO\xrightarrow{+{{O}_{2}}}N{{O}_{2}}\xrightarrow{+{{O}_{2}}+{{H}_{2}}O}HN{{O}_{3}}\)
E. MUỐI NITRAT ( Chứa ion NO3-)
1. Tính chất hóa học
- Dễ bị phân hủy bởi nhiệt
Nhóm I nhiệt phân tạo muối nitrơ và O2:
Ví dụ: 2KNO3 2KNO2 + O2↑
Nhóm II nhiệt phân tạo oxit, NO2 và O2:
Ví dụ: 2Cu(NO3)2 \(\xrightarrow{{{t}^{o}}}\) 2CuO + 4NO2 ↑+ O2↑
Nhóm III nhiệt phân tạo kim loại, NO2 và O2:
Ví dụ: 2AgNO3\(\xrightarrow{{{t}^{o}}}\) 2Ag + 2NO2 ↑+ O2↑
- Nhận biết ion NO3- : sử dụng: Cu + H2SO4 (hoặc HCl)
3Cu +8 H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
(xuất hiện dd xanh lam và khí không màu hóa nâu)
2. Ứng dụng:
- Thuốc nổ đen(thuốc nổ có khói): KNO3 + S +C
F. PHOTPHO
1. Tính chất vật lí
- Photpho trắng: Rất độc, gây bỏng nặng khi rơi vào da, ở nhiệt độ thường phát quang màu lục nhạt trong bóng tối, bốc cháy trong không khí ở nhiệt độ > 400C
- Photpho đỏ: Là chất bột màu đỏ, dễ hút ẩm và chảy rữa, cấu trúc polime → khó nóng chảy và khó bay hơi hơn photpho trắng, không tan trong các dung môi thông thường, bền trong không khí ở nhiệt độ thường, bốc cháy ở nhiệt độ > 2500C
P trắng \(\xrightarrow{{{250}^{0}}C}\) P đỏ
2. Tính chất hóa học
Photpho hoạt động hóa học mạnh hơn nitơ
- Tính oxi hóa:
P + kim loại hoạt động → photphua kim loại
VD: \(\overset{0}{\mathop{P}}\,+Ca\xrightarrow{{{t}^{0}}}C{{a}_{3}}\overset{-3}{\mathop{P}}\,(Canxiphotphua)\)
- Tính khử:
|
P + oxi: \(4\overset{0}{\mathop{P}}\,+3{{O}_{2}}(th)\xrightarrow{{{t}^{0}}}2\overset{+3}{\mathop{P}}\,{{}_{2}}{{O}_{3}}\) \(4\overset{0}{\mathop{P}}\)+ 5O2(dư\(\xrightarrow{{{t}^{0}}}2\overset{+5}{\mathop{P}}\,{{}_{2}}{{O}_{5}}\) |
P + halogen:
2\(\overset{0}{\mathop{P}}\,\)+ 3Cl2(thiếu) \(\xrightarrow{{{t}^{0}}}2\overset{+3}{\mathop{P}}\,C{{l}_{3}}\)
2\(\overset{0}{\mathop{P}}\,\)+ 5Cl2(thiếu) \(\xrightarrow{{{t}^{0}}}2\overset{+5}{\mathop{P}}\,C{{l}_{5}}\)
3. Ứng dụng:
- Sản xuất axit photphoric
- Sản xuất diêm, bom, đạn…
4. Trạng thái tự nhiên:
- Dạng muối photphoric như apatit 3Ca3(PO4)2.CaF2, photphorit Ca3(PO4)2
5. Sản xuất:
Ca3(PO4)2 + 3SiO2 + 5C \(\xrightarrow{{{120}^{0}}}\).3CaSiO3 + 2P + 5CO
G. AXIT PHOTPHORIC (H3PO4)
1. Tính chất vật lí
- Là chất rắn dạng tinh thể, trong suốt, không màu, rất háo nước => dễ chảy rữa
- Axit photphoric thường dùng là dung dịch đặc, sánh
2. Tính chất hóa học:
- Tính oxi hóa – khử:
Photpho có mức oxi hóa +5 bền hơn nitơ => axit H3PO4 khó bị khử => không có tính oxi hóa như axit HNO3
- Tính axit:
+ Axit H3PO4 là axit ba lần axit, có độ mạnh trung bình => Có đầy đủ tính chất chung của axit
+ Tác dụng với bazơ: Sản phẩm tạo thành phụ thuộc vào x
Đặt \(x=\frac{{{n}_{NaOH}}}{{{n}_{{{H}_{3}}P{{O}_{4}}}}}\)
3. Điều chế
- Trong phòng thí nghiệm:
P + 5HNO3(đặc) \(\xrightarrow{{{t}^{0}}}\) H3PO4 + 5NO2 ↑ + H2O
- Trong công nghiệp:
Ca3(PO4)2 + 3H2SO4(đặc) \(\xrightarrow{{{t}^{0}}}\) 3CaSO4↓ + 2H3PO4
H. MUỐI PHOTPHAT (PO43-)
1. Tính tan:
- Tất cả các muối đihiđrophotphat đều tan trong nước
- Muối photphat trung hòa và muối hiđrophotphat: trừ muối Na+, K+, NH4+ là dễ tan, còn lại đều không tan hoặc ít tan trong nước.
2. Nhận biết ion photphat:
Dùng thuốc thử AgNO3 :
3Ag+ + PO43- → Ag3PO4màu vàng
3. PHÂN BÓN HÓA HỌC
Phân đạm: Độ dinh dưỡng = %N
Phân lân: Độ dinh dưỡng = %P2O5
Phân kali: Độ dinh dưỡng = %K2O
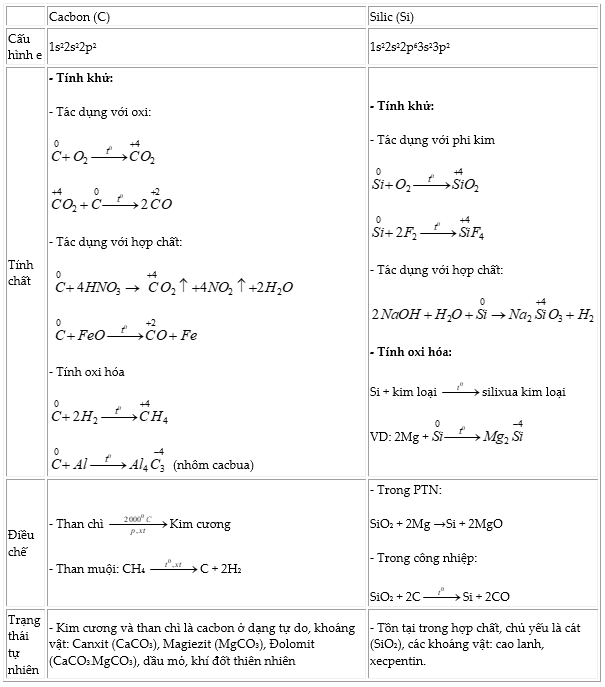
CHƯƠNG 3: CACBON – SILIC
I. Nhóm Cacbon:
- Vị trí: nhóm IVA; thành phần: C, Si, Ge, Sn, Pb
- Cấu hình e: ns2np2
- Các tính chất biến đổi có quy luật của đơn chất và hợp chất: C → Pb
II. Đơn chất
III. Hợp chất
|
Tên |
CTHH |
Tính chất |
Điều chế |
|
Cacbon đioxit |
CO2 |
- Khí, nặng hơn KK, không cháy, không duy trì sự cháy - Là một oxit axit tác dụng với bazơ: OH- + CO2 → CO32- +H2O. OH + CO2 → HCO3- Đặt x= \(\frac{{{n}_{O{{H}^{-}}}}}{{{n}_{C{{O}_{2}}}}}\) Sản phẩm tạo thành phụ thuộc vào x + 2Mg \(\xrightarrow{{{t}^{0}}}\overset{+2}{\mathop{C}}\,O\)+ 2MgO |
- PTN: CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
|
|
Cacbon monooxit |
CO |
- Khí, bền, độc - Là một oxit trung tính. - Là chất khử mạnh: chỉ khử được các oxit của kim loại yếu hơn Al MxOy + \(y\overset{+2}{\mathop{\text{ }C}}\,O\xrightarrow{{{t}^{0}}}xM+y\overset{+4}{\mathop{\text{ }C}}\,{{O}_{2}}\) |
- Trong CN: C + H2O khí than ướt CO2 + C \(\xrightarrow{{{t}^{0}}}\) khí lò gas - Trong PTN: HCOOH \(\xrightarrow{{{t}^{0}},{{H}_{2}}S{{O}_{4\text{d}}}}\) CO + H2O
|
|
Axit cacbonic |
H2CO3 |
- Là axit rất yếu và kém bền - Phân li 2 nấc - Dễ bị phân hủy: H2CO3 → CO2↑ + H2O |
|
|
Muối cacbonat |
CO32-
HCO3- |
- Dễ tan - Tính chất hóa học: +) Muối CO32- có tính bazơ: CO32- + 2H+ → H2O + CO2 +) Muối HCO3- có tính lưỡng tính: HCO3- + H+ → H2O + CO2 HCO3- + OH- → CO32- + H2O - Phản ứng nhiệt phân: 2NaHCO3 \(\xrightarrow{{{t}^{0}}}\) Na2CO3 + CO2↑ + H2O CaCO3 \(\xrightarrow{{{t}^{0}}}\) CaO + CO2↑ |
|
|
Silic đioxit |
SiO2 |
- Không tan trong nước, chất ở dạng tinh thể thạch anh. - Tính chất: + Tính chất oxit axit: SiO2 + 2NaOH(nóng chảy) \(\xrightarrow{{{t}^{0}}}\) Na2SiO3 + H2O - Tác dụng với HF: SiO2 + 4HF → SiF4 + 2H2O → Dùng HF khắc chữ lên thủy tinh |
- Có trong tự nhiên (cát, thạch anh...) |
|
Axit Silixic |
H2SiO3 |
- Là axit rất yếu tồn tại ở thể rắn (< H2CO3) Na2SiO3 + CO2 + H2O → H2SiO3↓ + Na2CO3 |
|
|
Muối Silicat |
SiO32- |
- Thủy tinh lỏng: Na2SiO3 và K2SiO3 - Phản ứng thủy phân: Na2SiO3 + 2H2O → 2NaOH + H2SiO3 |
|
dapandethi.vn