Lý thuyết luyện tập: Axit, bazơ và muối. Phản ứng trao đổi ion trong dung dịch các chất điện li.
1. Thuyết axit - bazơ của A-rê-ni-út.
- Axit là chất khi tan trong nước phân li ra ion H+.
- Bazơ là những chất khi tan trong nước phân li ra ion OH-
- Hiđroxit lưỡng tính khi tan trong nước vừa có thể phân li như axit vừa phân li như bazơ.
- Hầu hết các muối khi tan trong nước, điện li hoàn toàn ra cation kim loại (hoặc cation NH4+) và anion gốc axit.
+ Nếu gốc axit còn chứa hiđro có tính axit, thì gốc đó điện li yếu ra cation H+ và anion gốc axit.
2. Tích số ion của nước
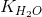 = [H+].[OH-] = l,0.10-14(ở 25°C).
= [H+].[OH-] = l,0.10-14(ở 25°C).
- Nó là hằng số trong nước cũng như trong dung dịch loãng của các chất khác nhau.
3. Giá trị [H+] và pH đặc trưng cho các môi trường
- Môi trường trung tính: [H+] = 10-7 M hay pH = 7,0
- Môi trường axit: [H+] > 10-7 M hay pH < 7,0
- Môi trường kiềm: [H+] < 10-7 M hay pH > 7,0
4. Điểu kiện xảy ra phản ứng trao đổi ion trong dung dịch
- Tạo thành chất kết tủa.
- Tạo thành chất điện li yếu.
- Tạo thành chất khí.
5. Phương trình ion rút gọn cho biết bản chất của phản ứng trong dung dịch các chất điện li. Trong phương trình ion rút gọn của phản ứng, người ta lược bỏ những ion không tham gia phản ứng. Còn những chất kết tủa, điện li yếu, chất khí được giữ nguyên dưới dạng phân tử.
