Đề bài
I. TRẮC NGHIỆM
Câu 1 : Oxi và ozon là
A. hai hợp chất của oxi.
B. hai đồng vị của oxi.
C. hai dạng dạng thù hình của oxi.
D. hai đồng phân của oxi.
Câu 2 : Cho m gam Al phản ứng với dung dịch H2SO4 đặc, nóng vừa đủ kết thúc phản ứng thu được 6,72 lít khí sunfurơ (đktc). Giá trị m là
A. 6,7 gam.
B. 2,7 gam.
C. 4,5 gam.
D. 5,4 gam.
Câu 3 : Kim loại nào sau đây thụ động với dung dịch H2SO4 đặc nguội?
A. Fe và Cu.
B. Al và Zn.
C. Al và Fe.
D. Fe và Mg.
Câu 4 : Sự tăng áp suất có ảnh hưởng như thế nào đến trạng thái cân bằng hóa học của phản ứng: H2 (k) + Br2 (k) ⇄ 2HBr (k)?
A. Cân bằng chuyển dịch theo chiều nghịch.
B. Cân bằng không thay đổi.
C. Phản ứng trở thành 1 chiều.
D. Cân bằng chuyển dịch theo chiều thuận.
Câu 5 : Sục từ từ để cho 4,48 lít khí SO2 (đktc) tác dụng hoàn toàn với 100 ml dung dịch NaOH 3M. Muối tạo thành sau phản ứng là
A. NaHSO3.
B. hỗn hợp Na2SO3 và NaHSO3.
C. Na2SO3.
D. Na2SO4.
Câu 6 : Cho phản ứng hóa học Br2 + HCOOH → 2HBr + CO2. Lúc đầu nồng độ của HCOOH là 0,01 mol/l, sau 40 giây nồng độ của HCOOH là 0,008 mol/l. Tốc độ trung bình của phản ứng trong khoảng thời gian 40 giây tính theo HCOOH là
A. 5,0.10-5 mol/(l.s).
B. 2,0.10-4 mol/(l.s).
C. 2,5.10-5 mol/(l.s).
D. 2,5.10-4 mol/(l.s).
Câu 7 : Tính chất hóa học đặc trưng của H2S là
A. vừa có tính oxi hóa, vừa có tính khử.
B. tính oxi hóa mạnh.
C. tính axit mạnh, tính khử yếu.
D. tính khử mạnh.
Câu 8 : Đốt 13 gam bột một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2 gam. Kim loại đó là
A. Mg.
B. Cu.
C. Zn.
D. Ca.
Câu 9 : Người ta điều chế oxi trong phòng thí nghiệm bằng phản ứng nhiệt phân chất nào sau đây?
A. CaCO3.
B. NaHCO3.
C. (NH4)2SO4.
D. KMnO4.
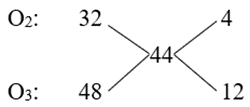
Câu 10 : Tỉ khối của một hỗn hợp gồm oxi và ozon đối với khí hiđro bằng 22. Thành phần phần trăm về thể tích của oxi và ozon lần lượt là
A. 25% và 75%.
B. 44% và 56%.
C. 35% và 75%.
D. 75% và 25%.
Câu 11 : Khi bị vỡ nhiệt kế có chứa thủy ngân, cách thu gom thủy ngân an toàn nhất là dùng
A. lưu huỳnh.
B. cacbon.
C. vôi sống.
D. giấm.
Câu 12 : Vị trí của oxi trong bảng tuần hoàn là
A. ô thứ 8, chu kì 3, nhóm VIA.
B. ô thứ 8, chu kì 2, nhóm VIA.
C. ô thứ 16, chu kì 3 nhóm VIA.
D. ô thứ 16, chu kì 2, nhóm VIA.
Câu 13 : Cho 12 gam hỗn hợp X gồm hai kim loại đồng và nhôm tác dụng hết trong dung dịch H2SO4 đặc, nguội, lấy dư thu được 3,36 lít SO2 (đktc). Thành phần % khối lượng của Al trong hỗn hợp là
A. 80,00%.
B. 62,31%.
C. 20,00%.
D. 73,85%.
Câu 14 : Cho phản ứng sau: Cl2 + 2H2O + SO2 → 2HCl + H2SO4. Vai trò của Cl2 trong phản ứng trên là
A. chất khử.
B. chất oxi hóa.
C. môi trường.
D. vừa chất oxi hóa, vừa chất khử.
Câu 15 : Để nhận biết I2 người ta dùng thuốc thử là
A. hồ tinh bột.
B. quỳ tím.
C. dung dịch AgNO3.
D. dung dịch BaCl2.
Câu 16 : Clo có các số oxi hóa là
A. -1, 0, +1, +2, +3, +5.
B. -1, 0, +2, +6, +5, +7.
C. -1, 0, +1, +2, +5, +7.
D. -1, 0, +1, +3, +5, +7.
II. TỰ LUẬN (6,0 điểm)
Câu 17 : Cho 7,14 gam một muối kali của halogen tác dụng với dung dịch AgNO3 dư thu được 11,28 gam kết tủa. Xác định tên halogen.
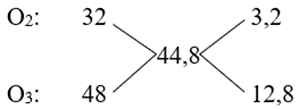
Câu 18 : Có hỗn hợp A gồm O2 và O3 có tỉ khối hơi so với hiđro là 22,4. Tính phần trăm thế tích của O3 trong hỗn hợp A.
Câu 19 : Cho 4,8 gam hỗn hợp Fe và Cu tác dụng vừa đủ với dung dịch H2SO4 đặc nóng 98% thu được 2,24 lít khí SO2 (đktc).
a) Tính thành phần phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b) Tính khối lượng dung dịch H2SO4 đặc nóng 98% đã dùng.
c) Cho lượng SO2 thu được ở trên vào 150 ml dung dịch KOH 1M. Tính khối lượng muối thu được.
----- HẾT -----
Lời giải chi tiết
ĐÁP ÁN VÀ LỜI GIẢI CHI TIẾT
|
1.C |
2.D |
3.C |
4.B |
5.B |
6.A |
7.D |
8.C |
|
9.D |
10.A |
11.A |
12.B |
13.C |
14.B |
15.A |
16.D |
Câu 1
Phương pháp:
Lý thuyết về oxi - ozon.
Cách giải:
Oxi và ozon là hai dạng dạng thù hình của oxi.
Chọn C.
Câu 2
Phương pháp:
Dựa vào phương pháp bảo toàn e để xác định khối lượng Al.
Cách giải:
nSO2 = 6,72/22,4 = 0,3 mol.
Quá trình nhận e:
S+6 + 2e → S+4
0,6 ← 0,3 (mol)
Quá trình nhường e:
Al → Al3+ + 3e
0,2 ← 0,6 (mol)
⟹ mAl = 0,2.27 = 5,4 gam.
Chọn D.
Câu 3
Phương pháp:
Dựa vào tính chất hóa học của axit sunfuric đặc nguội.
Cách giải:
Axit sunfuric đặc nguội thụ động với các kim loại Al, Fe, Cr.
Chọn C.
Câu 4
Phương pháp:
Nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, áp suất, nhiệt độ, thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó.
Cách giải:
Ta thấy tổng hệ số của khí bên vế trái bằng tổng hệ số của khí bên vế phải nên áp suất không ảnh hưởng đến cân bằng này.
Chọn B.
Câu 5
Phương pháp:
*Cho SO2 tác dụng với NaOH (làm tương tự với KOH): (1) SO2 + 2NaOH → Na2SO3 + H2O
(2) SO2 + NaOH → NaHSO3
Lập tỉ lệ (*) = nNaOH/nSO2
+ (*) ≥ 2 thì SO2 hết, NaOH dư hoặc vừa đủ ⟹ tạo muối Na2SO3
PTHH: SO2 + 2NaOH → Na2SO3 + H2O
+ (*) ≤ 1 thì NaOH hết, SO2 dư hoặc vừa đủ ⟹ phản ứng tạo muối NaHSO3
PTHH: SO2 + NaOH → NaHSO3
+ 1 < (*) < 2 thì tạo 2 muối Na2SO3 và NaHSO3
PTHH:
(1) SO2 + 2NaOH → Na2SO3 + H2O
(2) SO2 + NaOH → NaHSO3
Cách giải:
nSO2 = 4,48/22,4 = 0,2 mol; nNaOH = 0,3.1 = 0,3 mol.
Ta thấy 1 < nNaOH/nSO2 = 1,5 < 2 ⟹ tạo 2 muối NaHSO3 và Na2SO3.
Chọn B.
Câu 6
Phương pháp:
Dựa vào công thức tính tốc độ phản ứng: \(\bar v = \frac{{\Delta C}}{{\Delta t}} = \frac{{\left| {{C_2} - {C_1}} \right|}}{{({t_2} - {t_1})}}\).
Cách giải:
Tốc độ trung bình của phản ứng trong khoảng thời gian 40 giây tính theo HCOOH là:
\(\bar v = \frac{{\Delta C}}{{\Delta t}} = \frac{{\left| {0,008 - 0,01} \right|}}{{40}} = {5.10^{ - 5}}mol/(l.s)\).
Chọn A.
Câu 7
Phương pháp:
Dựa vào tính chất hóa học của H2S.
Cách giải:
S trong H2S có số oxi hóa -2 nên H2S là chất có tính khử mạnh.
Chọn D.
Câu 8
Phương pháp:
PTHH: 2X + O2 → 2XO
Theo PTHH trên ta thấy: nX = nXO ⟹ phương trình ẩn MX ⟹ giá trị của MX ⟹ Kim loại.
Cách giải:
PTHH: 2X + O2 → 2XO
Theo PTHH trên ta thấy: nX = nXO ⟹ \(\frac{{13}}{{{M_X}}} = \frac{{16,2}}{{{M_X} + 16}} \to {M_X} = 65\)
⟹ Kim loại đó là kẽm (Zn).
Chọn C.
Câu 9
Phương pháp:
Dựa vào nguyên tắc điều chế khí oxi trong phòng thí nghiệm.
Cách giải:
Nguyên tắc điều chế khí oxi trong phòng thí nghiệm là nhiệt phân muối giàu oxi và dễ phân hủy.
A. CaCO3 \(\xrightarrow{{{t}^{o}}}\) CaO + CO2.
B. 2NaHCO3 \(\xrightarrow{{{t}^{o}}}\) Na2CO3 + CO2 + H2O.
C. (NH4)2SO4 \(\xrightarrow{{{t}^{o}}}\) 2NH3 + H2SO4.
D. 2KMnO4 \(\xrightarrow{{{t}^{o}}}\) K2MnO4 + MnO2 + O2.
Chọn D.
Câu 10
Phương pháp:
Áp dụng phương pháp đường chéo ⟹ tỉ lệ nO2 : nO3 ⟹ % về thể tích của O2 và O3.
Cách giải:
Phương pháp đường chéo:
\( \Rightarrow \frac{{{n_{{O_2}}}}}{{{n_{{O_3}}}}} = \frac{4}{{12}} \Rightarrow \frac{{{n_{{O_2}}}}}{{{n_{{O_3}}}}} = \frac{1}{3}\)
Xét nO2 = 1 mol; nO3 = 3 mol
⟹ %VO2 = \(\frac{1}{{1 + 3}}.100\% \) = 25%;
%VO3 = 100% - 25% = 75%.
Chọn A.
Câu 11
Cách giải:
Thu gom thủy ngân rơi vãi bằng bột lưu huỳnh: S + Hg → HgS ↓.
Sản phẩm HgS sinh ra dưới dạng chất rắn nên dễ dàng thu gom và xử lí.
Chọn A.
Câu 12
Phương pháp:
Dựa vào cấu hình electron nguyên tử của oxi để xác định vị trí oxi trong bảng tuần hoàn các nguyên tố hóa học.
Cách giải:
Cấu hình electron nguyên tử của oxi (Z = 8): 1s22s22p4
⟹ Oxi thuộc ô thứ 8, chu kì 2, nhóm VIA.
Chọn B.
Câu 13
Phương pháp:
Vì Al thụ động với dung dịch H2SO4 đặc nguội nên chỉ có Cu tác dụng với H2SO4 tạo khí SO2.
PTHH: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
Từ số mol SO2 suy ra số mol Cu ⟹ mCu ⟹ mAl ⟹ % khối lượng Al.
Cách giải:
nSO2 = 3,36/22,4 = 0,15 mol.
Vì Al thụ động với dung dịch H2SO4 đặc nguội nên chỉ có Cu tác dụng với H2SO4 tạo khí SO2.
PTHH: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
0,15 ← 0,15 (mol)
⟹ mCu = 0,15.64 = 9,6 gam
⟹ mAl = 12 - 9,6 = 2,4 gam
⟹ %mAl = (2,4/12).100% = 20%.
Chọn C.
Câu 14
Phương pháp:
Dựa vào sự thay đổi số oxi hóa của Cl2 để xác định vai trò Cl2.
Cách giải:
\({\mathop {Cl}\limits^0 _2} + 2{H_2}O + \mathop S\limits^{ + 4} {O_2} \to 2H\mathop {Cl}\limits^{ - 1} + {H_2}\mathop S\limits^{ + 6} {O_4}\)
Số oxi hóa của Cl giảm từ 0 xuống -1 ⟹ Cl2 là chất oxi hóa
Số oxi hóa của S tăng từ +4 lên +6 ⟹ SO2 là chất khử.
Chọn B.
Câu 15
Phương pháp:
Dựa vào tính chất hóa học của I2.
Cách giải:
Dùng hồ tinh bột để nhận biết I2 do có hiện tượng tạo dung dịch có màu xanh tím.
Chọn A.
Câu 16
Phương pháp:
Lý thuyết về clo.
Cách giải:
Clo có các số oxi hóa là -1, 0, +1, +3, +5, +7.
Chọn D.
Câu 17
Phương pháp:
PTHH: KX + AgNO3 → AgX + KNO3.
Theo PTHH: nKX = nAgX ⟹ MX ⟹ Tên của halogen.
Cách giải:
PTHH: KX + AgNO3 → AgX + KNO3.
Theo PTHH: nKX = nAgX ⟹ \(\frac{{7,14}}{{39 + {M_X}}} = \frac{{11,28}}{{108 + {M_X}}}\)
⟹ mX = 80.
Vậy halogen là brom (Br).
Câu 18
Phương pháp:
Sử dụng phương pháp đường chéo ⟹ tỉ lệ nO2 : nO3 ⟹ % về thể tích của O2, O3.
Cách giải:
dA/H2 = 22,4 ⟹ MA = 22,4.MH2 = 44,8.
Phương pháp đường chéo:
\( \Rightarrow \frac{{{n_{{O_2}}}}}{{{n_{{O_3}}}}} = \frac{{3,2}}{{12,8}} \Rightarrow \frac{{{n_{{O_2}}}}}{{{n_{{O_3}}}}} = \frac{1}{4}\)
Xét nO2 = 1 mol; nO3 = 4 mol
⟹ %VO2 = \(\frac{1}{{1 + 4}}.100\% \) = 20%;
%VO3 = 100% - 20% = 80%.
Câu 19
a)
Phương pháp:
- Đặt ẩn là số mol mỗi kim loại trong hỗn hợp.
- Lập hệ phương trình:
+ Từ khối lượng hỗn hợp ban đầu ⟹ phương trình (1)
+ Áp dụng phương pháp bảo toàn e ⟹ phương trình (2)
- Giải hệ tìm được số mol mỗi kim loại ⟹ % khối lượng mỗi kim loại.
Cách giải:
Đặt nCu = x; nFe = y (mol)
+) mCu + mFe = 4,8 ⟹ 64x + 56y = 4,8 (1)
+) Áp dụng bảo toàn electron:
Quá trình nhường e:
Cu → Cu2+ + 2e
x → 2x (mol)
Fe → Fe3+ + 3e
y → 3y (mol)
Quá trình nhận e:
S+6 + 2e → S+4
0,2 ← 0,1 (mol)
⟹ 2x + 3y = 0,2 (2)
Từ (1) và (2) ⟹ x = nCu = 0,04 mol; y = nAl = 0,04 mol.
⟹ %mCu = \(\frac{{0,04.64}}{{4,8}}.100\% \) = 53,33%;
%mFe = 100% - 53,33% = 46,67%.
b)
Phương pháp:
Bài toán KL + H2SO4 đặc, nóng:
Cách thiết lập công thức số mol H2SO4 phản ứng:
Đặt công thức chung của KL là M, hóa trị n
2M → M2(SO4)n
2 mol 1 mol
Nhận thấy: n e nhường = 2n (mol); nSO42-(muối) = n mol
⟹ nSO42- (muối) = 0,5.ne = 0,5.(2nSO2 + 6nS + 8nH2S) = nSO2 + 3nS + 4nH2S
BTNT "S": nH2SO4 pư = nSO4(muối) + nSO2 + nS + nH2S
⟹ nH2SO4 pư = (nSO2 + 3nS + 4nH2S) + nSO2 + nS + nH2S = 2nSO2 + 4nS + 5nH2S
Vậy: nH2SO4 pư = 2nSO2 + 4nS + 5nH2S
Cách giải:
Công thức tính nhanh: nH2SO4 pư = 2nSO2 = 2.0,1 = 0,2 mol
⟹ mH2SO4 = 0,2.98 = 19,6 gam
⟹ mdd H2SO4 = 19,6.(100/98) = 20 gam.
c)
Phương pháp:
*Cho SO2 tác dụng với NaOH (làm tương tự với KOH):
(1) SO2 + 2NaOH → Na2SO3 + H2O
(2) SO2 + NaOH → NaHSO3
Lập tỉ lệ (*) = nNaOH/nSO2
+ (*) ≥ 2 thì SO2 hết, NaOH dư hoặc vừa đủ ⟹ tạo muối Na2SO3
PTHH: SO2 + 2NaOH → Na2SO3 + H2O
+ (*) ≤ 1 thì NaOH hết, SO2 dư hoặc vừa đủ ⟹ phản ứng tạo muối NaHSO3
PTHH: SO2 + NaOH → NaHSO3
+ 1 < (*) < 2 thì tạo 2 muối Na2SO3 và NaHSO3
PTHH:
(1) SO2 + 2NaOH → Na2SO3 + H2O
(2) SO2 + NaOH → NaHSO3
Cách giải:
Ta thấy 1 < nKOH/nSO2 = 0,15/0,1 = 1,5 < 2 ⟹ Dung dịch tạo thành 2 muối K2SO3 và KHSO3.
Đặt nKHSO3 = a; nK2SO3 = b (mol).
KOH + SO2 → KHSO3
a ← a ← a (mol)
2KOH + SO2 → K2SO3 + H2O
2b ← b ← b (mol)
Ta có hệ phương trình:
\(\left\{ {\begin{array}{*{20}{l}}{a + b = {n_{S{O_2}}} = 0,1}\\{a + 2b = {n_{K{\rm{O}}H}} = 0,15}\end{array}} \right. \to \left\{ {\begin{array}{*{20}{l}}{a = 0,05}\\{b = 0,05}\end{array}} \right.\)
⟹ mmuối = mKHSO3 + mK2SO3 = 0,05.120 + 0,05.158 = 13,9 gam.
dapandethi.vn