Đề bài
I. PHẦN TRẮC NGHIỆM
Câu 1. Để xác định hàm lượng cacbon trong thép người ta đốt mẫu thép trong oxi thu lấy CO2. Đem đốt 100 gam một mẫu thép thu được 3 gam CO2. Phần trăm cacbon theo khối lượng trong mẫu thép này là:
A.1,10% B.0,82%
C.2,50% D.1,45%
Câu 2. Dãy nào sau đây được sắp xếp theo chiều giảm dần độ bền với nhiệt các hợp chất hiđrua (RH4) của các nguyên tố nhóm cacbon?
\(\begin{array}{l}A.C{H_4} > Si{H_4} > Ge{H_4} > Sn{H_4} > Pb{H_4}\\B.C{H_4} > Si{H_4} > Pb{H_4} > Sn{H_4} > Ge{H_4}\\C.Pb{H_4} > Sn{H_4} > Ge{H_4} > Si{H_4} > C{H_4}\\D.Si{H_4} > Ge{H_4} > Pb{H_4} > Sn{H_4} > C{H_4}\end{array}\)
Câu 3. Cho 182 gam hỗn hợp gồm Al2O3 và CuO phản ứng với bột cacbon ở nhiệt độ cao, thu được 11,2 lít khí CO2 (đktc). Thành phần phần trăm của mỗi oxit trong hỗn hợp ban đầu lần lượt là:
A.30,00% và 70,00%
B.25,00% va 75,00%
C.56,04% và 43,96%
D.45,15% và 54,85%
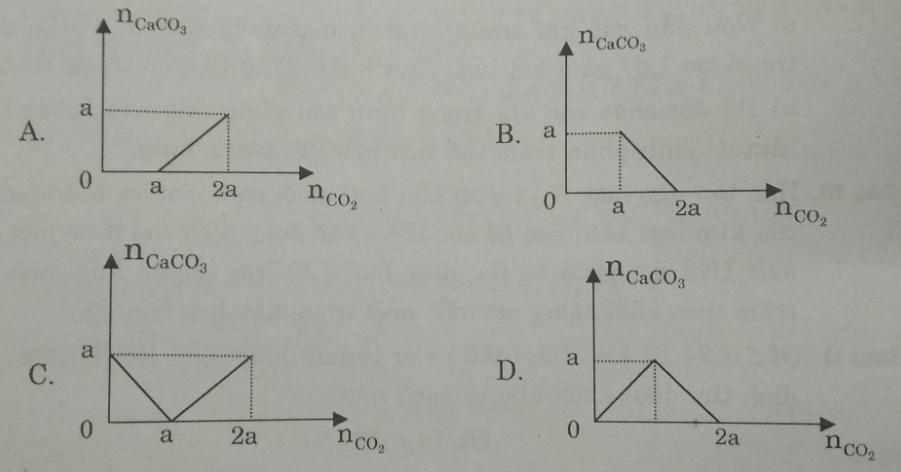
Câu 4. Sục từ từ CO2 vào dung dịch chứa a mol Ca(OH)2. Đồ thị nào sau đây biểu diễn số mol CaCO3 theo số mol CO2 là đúng?
Câu 5. Hòa tan hoàn toàn một lượng CaO vào nước thu được dung dịch X. Sục V lít khí CO2 (đktc) vào dung dịch X (dư) thu được 2,5 gam kết tủa. Giá trị của V là:
A.4,48 lít B. 0,56 lít
C.0,67% D.1,12 lít
Câu 6. Cho phân tử khối của 3 muối RCO3, R’CO3 và R’’CO3 lập thành một cấp số cộng với công sai bằng 16. Tổng số hạt proton, nơtron của ba hạt nhân nguyên tử trên là 120. Ba nguyên tố trên là dãy nào sau đây?
\(\begin{array}{l}A.Mg,Ca,Fe\\B.Ba,Mg,Ca\\C.Fe,Zn,Cu\\D.Mg,Ca,Cu\end{array}\)
Câu 7. Tỉ khối hơi của hỗn hợp X gồm CO2 và N2 đối với H2 bằng 18. Thành phần phần trăm theo khối lượng mỗi khí trong hỗn hợp ban đầu lần lượt là:
A.40% và 60%
B.25% và 75%
C.61,11% và 38,89%
D.33,33% và 66,67%
Câu 8. Dung dịch X chứa NaOH 1M và Ca(OH)2 0,01M. Dẫn 2,24 lít khí CO2 vào 400ml dung dịch X. Khối lượng khối lượng kết tủa thu được là:
A.11,0 gam B.0,4 gam
C.2,0 gam D.5,0 gam
II. PHẦN TỰ LUẬN
Câu 9. Trong một bình kín chứa một ít than và nước không có không khí. Nung nóng bình tới nhiệt độ cao. Giả sử chỉ xảy ra 2 phản ứng sau: \(\begin{array}{l}C + {H_2}O \to CO + {H_2}\\C + 2{H_2}O \to C{O_2} + 2{H_2}\end{array}\)
a) Nếu dẫn các khí trong bình đi qua dung dịch Ba(OH)2 dư thì thu được 1,97 gam kết tủa. Tính khối lượng CO2 có trong bình.
b) Để đốt cháy các khí trong bình sau phản ứng cần 2,464 lít oxi (đktc). Tính phần trăm thể tích mỗi khí trong bình.
Câu 10. Hòa tan vào nước 7,14 gam hỗn hợp muối cacbonat và hiđrocacbonat của kim loại xesi. Sau đó cho thêm vào dung dịch thu được một lượng axit HCl dư người ta thu được 0,672 lít khí (đktc). Xác định phần trăm theo khối lượng của mỗi muối trong hỗn hợp ban đầu.
Câu 11. Dẫn 2,24 lít khí CO2 (đktc) vào 100ml dung dịch KOH 1,5M. Dung dịch thu được chứa chứa những muối nào?
Lời giải chi tiết
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
B |
A |
C |
D |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
A |
C |
A |
Câu 1:
n CO2 = 3 : 44 = 0,068 mol
Áp dụng định luật bảo toàn nguyên tố C
=> n C = n CO2 = 0,068 mol
m C = 0,068 . 12 = 0,816 gam
=> % m C có trong thép là: 0,816 : 100 . 100% = 0,816%
Đáp án B
Câu 2:
Hợp chất hidrua của các nguyên tố trong cùng 1 nhóm có độ bền giảm dần theo chiều tăng điện tích hạt nhân
Đáp án A
Câu 3:
Ta có phương trình:
2CuO + C → 2Cu + CO2
n CO2 = 11,2 : 22,4 = 0,5 mol
=> m CuO = 1 . 80 = 80 gam
=> % m CuO = 80 : 182 . 100% = 43,96%
% m Al2O3 = 56,04%
Đáp án C
Câu 4:
Các phương trình hóa học diễn ra khi sục khí CO2 vào dung dịch Ca(OH)2 là:
Ca(OH)2 + CO2 → CaCO3 + H2O
a a a
CaCO3 + CO2 + H2O → Ca(HCO3)2
a a a
Đáp án D
Câu 5:
Ta có phương trình phản ứng:
CaO + H2O → Ca(OH)2
CO2 + Ca(OH)2 → CaCO3 + H2O
n CaCO3 = 2,5 : 100 = 0,025 mol
X dư => CO2 phản ứng hết
n CO2 = n Ca(OH)2 = 0,025 mol
V CO2 = 0,025 . 22,4 = 0,56 lít
Đáp án B
Câu 6:
Đáp án A
Câu 7:
Khối lượng mol trung bình của hỗn hợp khí là: 18 . 2 = 36
Gọi số mol của CO2, N2 lần lượt là x, y
=> (44x + 28y) : (x + y) = 36
=> x = y
Gỉa sử số mol CO2, N2 có x mol
=> % m CO2 = 44 : (44 + 28) . 100% = 61,11%
% m N2 = 38,89%
Đáp án C
Câu 8:
n CO2 = 2,24 : 22,4 = 0,1 mol
n NaOH = 0,4 . 1 = 0,4 mol
n Ca(OH)2 = 0,4 . 0,01 = 0,004 mol
n OH = 0,004 . 2 + 0,4 = 0,408 mol
Ta có : n OH : n CO2 = 0,408 : 0,1 = 4,08
=> Sau phản ứng kiềm dư, CO2 hết
n CaCO3 = n Ca(OH)2 = 0,004 . 100 = 0,4 gam
Đáp án A
II. PHẦN TỰ LUẬN
Câu 9.
a) Tính khối lượng CO2:
Khi dẫn các khí qua dung dịch Ba(OH)2 dư thì CO2 bị hấp thu:
\(\begin{array}{l}C{O_2} + Ba{\left( {OH} \right)_2} \to BaC{O_3} + {H_2}O{\rm{ }}\left( 1 \right)\\0,01{\rm{ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; }} \leftarrow {\rm{ 0,01 }}\left( {mol} \right)\end{array}\)
Ta có: \({n_{BaC{O_3}}} = \dfrac{{19,7}}{{197}} = 0,01\left( {mol} \right)\)
Từ (1) \( \Rightarrow {n_{C{O_2}}} = 0,01\left( {mol} \right)\)
\(\Rightarrow {m_{C{O_2}}} = 0,01 \times 44 = 0,44\left( {gam} \right)\)
b) Phần trăm của mỗi khí trong bình:
Cách 1:
Các phản ứng xảy ra trong bình:
\(\begin{array}{l}C + {H_2}O \to CO + {H_2}{\rm{ }}\left( 1 \right)\\C + 2{H_2}O \to C{O_2} + 2{H_2}{\rm{ }}\left( 2 \right)\end{array}\)
Phản ứng đốt cháy các khí trong bình:
\(\begin{array}{l}2CO + {O_2} \to 2C{O_2}{\rm{ }}\left( 3 \right)\\2{H_2} + {O_2} \to 2{H_2}O{\rm{ }}\left( 4 \right)\end{array}\)
Gọi V1, V2 và V3 lần lượt là thể tich của các khí CO2, H2 và CO trong bình (đktc).
Từ (1) \({V_1} = \dfrac{{0,44 \times 22,4}}{{44}} = 0,224\left( l \right){\rm{ }}\left( * \right)\)
Từ (3), (4) ta có: \({V_2} + {V_3} = 2 \times 2,464 = 4,928\left( l \right){\rm{ }}\left( {**} \right)\)
Theo phản ứng (1) và (2) ta có V3 = V2 - 2V1 (***)
Giải (*), (**) và (***) ta được: \(\left\{ \begin{array}{l}{V_1} = 0,224\\{V_2} = 2,688\\{V_3} = 2,24\end{array} \right.\)
Tổng thể tích của 3 khí trong bình:
\({V_1} + {V_2} + {V_3} = 0,224 + 2,688 + 2,24 \)\(\,= 5,152\left( {lit} \right)\)
Vậy: \(\% {V_{C{O_2}}} = \dfrac{{0,224}}{{5,152}} \times 100\% = 4,35\% \)
\(\begin{array}{l}\% {V_{CO}} = \dfrac{{2,24}}{{5,152}} \times 100\% = 43,48\% \\\% {V_{{H_2}}} = 52,17\% \end{array}\)
Cách 2.
Gọi a, b và c là số mol của CO2, H2 và CO.
\(\begin{array}{l} \Rightarrow a = \dfrac{{0,44}}{{44}} = 0,01\left( {mol} \right){\rm{ }}\left( * \right)\\{\rm{ b + c = 2}} \times \dfrac{{2,464}}{{22,4}} = 0,22{\rm{ }}\left( {**} \right)\\{\rm{ c = b - 2a }}\left( {***} \right)\end{array}\)
Giải (*), (**) và (***) ta được: \(\left\{ \begin{array}{l}a = 0,01\\b = 0,12\\c = 0,1\end{array} \right.\)
Vì là chất khí nên %V = %n
Vậy:
\(\% {V_{C{O_2}}} = \% {n_{C{O_2}}} = \dfrac{{0,01}}{{0,23}} \times 100\% = 4,35\% \)
\(\begin{array}{l}\% {V_{CO}} = \% {n_{CO}} = \dfrac{{0,1}}{{0,23}} \times 100\% = 43,48\% \\\% {V_{{H_2}}} = \% {n_{{H_2}}} = 100\% - \left( {4,35\% + 43,48\% } \right) = 52,17\% \end{array}\)
Câu 10.
Ta có: \({n_{C{O_2}}} = \dfrac{{0,672}}{{22,4}} = 0,03\left( {mol} \right)\)
Gọi a là số mol của muối Cs2CO3 và b là số mol của muối CsHCO3.
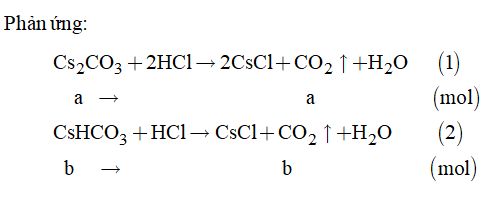
Theo đề bài, ta có hệ phương trình:
\(\left\{ \begin{array}{l}326a + 194b = 7,14\\a + b = 0,03\end{array} \right.\)
Giải hệ phương trình, ta được: \(\left\{ \begin{array}{l}a = 0,01\\b = 0,02\end{array} \right.\)
Vậy: \(\% {m_{C{s_2}C{O_3}}} = \dfrac{{0,01 \times 326}}{{7,14}} \times 100\% = 45,66\% \)
\(\% {m_{CsHC{O_3}}} = 100\% - 45,66\% = 54,34\% .\)
Câu 11.
Ta có: \({n_{C{O_2}}} = \dfrac{{2,24}}{{22,4}} = 0,1\left( {mol} \right);\)
\({n_{KOH}} = 0,1 \times 1,5 = 0,15\left( {mol} \right)\)
Lập tỉ số: \(1 < \dfrac{{{n_{KOH}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,15}}{{0,1}} = 1,5 < 2\)
\( \Rightarrow \) Sau khi dẫn CO2 vào dung dịch KOH thì tạo thành 2 muối: K2CO3 và KHCO3.
dapandethi.vn
