Câu hỏi 1 :
Cho 200 ml dd X gồm Ba(OH)2 0,5M và NaAlO2(hay Na[Al(OH)4]) 1,5M. Thêm từ từ dung dịch H2SO4 0,5M vào X cho đến khi kết tủa tan trở lại một phần, thu được kết tủa Y. Đem nung Y đến khối lượng không đổi được 24,32g chất rắn Z. Thể tích dd H2SO4 0,5M đã dùng là
- A 0,55 lít.
- B 1,34 lít.
- C 0,67 lít.
- D 1,10 lít.
Đáp án: B
Phương pháp giải:
Nếu cho H+ tác dụng với dung dịch [Al(OH)4]- thì xảy ra 1 hoặc 2 phản ứng sau:
[Al(OH)4]- + H+ → Al(OH)3 + H2O (1)
Al(OH)3 + 3H+→ Al3+ + 3H2O (2)
Nếu đặt: n[Al(OH)4]- = a mol; nH+ = b mol thì:
+ Nếu b/a 1 thì
nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và
nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Lời giải chi tiết:
nBa(OH)2 = 0,1 mol ; nNaAlO2 = 0,3 mol
Kết tủa tan trở lại 1 phần :
OH- + H+ -> H2O
AlO2- + H+ + H2O -> Al(OH)3
Al(OH)3 + 3H+ -> Al3+ + 3H2O
=> BaSO4 đạt kết tủa tối đa và còn một lượng Al2O3
=> nAl2O3 = 0,01 mol => nAl(OH)3 = 0,02 mol
=> nH+ = nOH- + 4nAlO2 – 3nAl(OH)3 = 1,34 mol
=> Vdd H2SO4 = 1,34 lit
Đáp án B
Câu hỏi 2 :
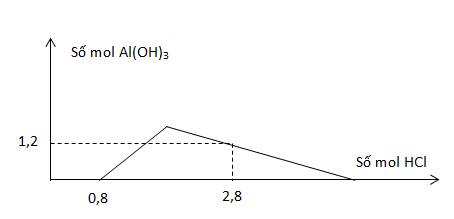
Cho từ từ dung dịch HCl vào dung dịch chứa a mol Ba(AlO2)2 và b mol Ba(OH)2. Số mol Al(OH)3 tạo thành phụ thuộc vào số mol HCl được biểu diễn bằng đồ thị hình bên. Tỉ lệ a:b tương ứng là
- A 9:4.
- B 4:9.
- C 7:4.
- D 4:7.
Đáp án: C
Phương pháp giải:
nOH- => nBa(OH)2
Viết phương trình ion rút gọn, tính toán theo phương trình hóa học.
AlO2- + H+ + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
Lời giải chi tiết:
\(HCl + \left\{ \begin{gathered}
Ba{(Al{O_2})_2}:a\,mol \hfill \\
Ba{(OH)_2}:\,b\,mol \hfill \\
\end{gathered} \right.\)
nOH- = 0,8 => nBa(OH)2 = b = 0,4 mol
AlO2- + H+ + H2O → Al(OH)3
2a 2a
Al(OH)3 + 3H+ → Al3+ + 3H2O
2a-1,2
3(2a-1,2)+2a=2 => a = 0,7
=> a:b = 7:4
Đáp án C
Câu hỏi 3 :
Cho dung dịch A chứa 0,05 mol Na[Al(OH)4] và 0,1 mol NaOH tác dụng với dung dịch HCl 2M. Thể tích dung dịch HCl 2M lớn nhất cho vào dung dịch A để xuất hiện 1,56gam kết tủa là
- A 0,06 lít
- B 0,18 lít
- C 0,12 lít
- D 0,08 lít
Đáp án: C
Lời giải chi tiết:
nHCl trung hoà NaOH = 0,1 mol.
a = 0,05 mol; b = 0,02 mol => b < a
Đề bài yêu cầu tính thể tích HCl lớn nhất có nghĩa là phải tính nH+max thì nH+ = 4a – 3b = 0,14 mol.
=> VHCl = (0,1 + 0,14) / 2 = 0,12 lít
Đáp án C
Câu hỏi 4 :
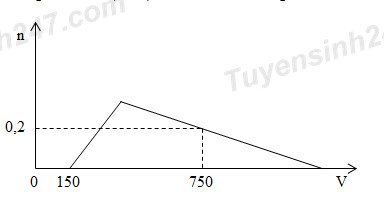
Cho từ từ dung dịch HCl 1M vào dung dịch chứa x mol NaOH và y mol NaAlO2. Số mol Al(OH)3 (n mol) tạo thành phụ thuộc vào thể tích dung dịch HCl (V ml) được biểu diễn bằng đồ thị bên.
Giá trị của x và y lần lượt là
- A 0,30 và 0,35.
- B 0,15 và 0,35.
- C 0,15 và 0,30.
- D 0,30 và 0,30.
Đáp án: C
Phương pháp giải:
Quan sát và phân tích đồ thị thấy:
+ Tại V = 150 => NaOH bị trung hòa hết
+ Tại V = 750 => Al(OH)3 bị hòa tan một phần
Lời giải chi tiết:
Dựa vào đồ thị ta thấy:
+ Tại V = 150 ml: NaOH vừa bị trung hòa hết
nH+ = nOH- => x = 0,15 mol
+ Tại V = 750: Al(OH)3 bị hòa tan một phần
nH+ = nOH- + nAlO2- + 3(nAlO2- - nAl(OH)3) hay nH+ = nOH- + 4nAlO2- - 3nAl(OH)3
=> 0,75 = 0,15 + 4y – 3.0,2 => y = 0,3 mol
Đáp án C
Câu hỏi 5 :
Cần ít nhất bao nhiêu ml dung dịch HCl 1M cần cho vào 500 ml dung dịch Na[Al(OH)4] 0,1M để thu được 0,78 g chất kết tủa?
- A 10 ml
- B 100 ml
- C 15 ml
- D 170 ml
Đáp án: A
Phương pháp giải:
+ Nếu b/a 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Lời giải chi tiết:
Ta có: a = 0,05 mol; b = 0,01 mol => b < a
Đề bài yêu cầu tính VHCl nhỏ nhất có nghĩa là phải tính nH+ min thì nH+ = b = 0,01
=> V = 0,01 lít = 10 ml
Đáp án A
Câu hỏi 6 :
Cho dung dịch A chứa 0,05 mol Na[Al(OH)4] và 0,1 mol NaOH tác dụng với dung dịch HCl 2M. Thể tích dung dịch HCl 2M lớn nhất cho vào dung dịch A để xuất hiện 1,56 gam kết tủa là
- A 0,06 lít
- B 0,18 lít
- C 0,12 lít
- D 0,08 lít
Đáp án: C
Phương pháp giải:
+ Nếu b/a 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Lời giải chi tiết:
nAl(OH)3 còn lại = 1,56 : 78 = 0,02 mol
Thể tích lớn nhất của HCl khi có sự hòa tan một phần kết tủa.
NaOH + HCl → NaCl + H2O
0,1 → 0,1
Na[Al(OH)4] + HCl → NaCl + Al(OH)3 + H2O
0,05 → 0,05 → 0,05 => nAl(OH)3 bị tan = 0,05 - 0,02 = 0,03 (mol)
Al(OH)3 + 3HCl → AlCl3 + 3H2O
0,03 → 0,09
=> nHCl = 0,1 + 0,05 + 0,09 = 0,24 mol
=> V dd HCl = n : CM = 0,24 : 2 = 0,12 lít
Đáp án C
Câu hỏi 7 :
Thêm dung dịch HCl vào dung dịch hỗn hợp gồm 0,1 mol NaOH và 0,1 mol Na[Al(OH)4] thu được 0,08 mol chất kết tủa. Số mol HCl đã thêm vào là:
- A 0,16
- B 0,18 hoặc 0,26
- C 0,08 hoặc 0,16
- D 0,26
Đáp án: B
Phương pháp giải:
+ Nếu b/a 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Lời giải chi tiết:
Ta có: nHCl trung hoà NaOH = 0,1 mol.
a = 0,1 mol; b = 0,08 mol => b < a
TH1: Kết tủa chưa bị hòa tan: nHCl = nNaOH + b = 0,1 + 0,08 = 0,18 mol
TH2: Kết tủa bị hòa tan 1 phần nHCl = nNaOH + 4a – 3b = 0,1 + 4.0,1 - 3.0,08 = 0,26 mol
Đáp án B
Câu hỏi 8 :
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch chứa x mol NaOH và y mol NaAlO2 (hay Na[Al(OH)4]) kết quả thí nghiệm được biểu diễn bằng đồ thị sau:

Xác định tỉ lệ x: y?
- A 1:3
- B 4:3
- C 1:1
- D 2:3
Đáp án: B
Phương pháp giải:
Phân tích từng giai đoạn khi cho H+ vào dung dịch chứa OH- và AlO2-:
+) Giai đoạn 1: Từ điểm xuất phát đồ thị đến khi xuất hiện kết tủa
Chỉ xảy ra phản ứng trung hòa: H+ + OH- → H2O
+) Giai đoạn 2: Từ điểm xuất hiện kết tủa đến điểm giá trị kết tủa cực đại
PTHH: H+ + AlO2- + H2O → Al(OH)3
+) Giai đoạn 3: Từ điểm kết tủa cực đại đến điểm kết thúc đồ thị
Xảy ra phản ứng hòa tan kết tủa: 3H+ + Al(OH)3 → Al3+ + 3H2O
Lời giải chi tiết:
+) Tại điểm nHCl = 0,4: Trung hòa vừa hết NaOH
Khi đó: nNaOH = nHCl = 0,4 mol => x = 0,4 mol
+) Tại điểm nHCl = 0,6 mol: Chỉ xảy ra phản ứng tạo kết tủa.
H+ + AlO2- + H2O → Al(OH)3
+) Tại điểm nHCl = 1 mol: Kết tủa Al(OH)3 bị H+ hòa tan một phần
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
nAl(OH)3 bị tan = y – 0,2 (mol)
=> nHCl = nOH- + nAlO2- + 3nAl(OH)3 bị tan => 1 = 0,4 + y + 3(y – 0,2) => y = 0,3
Vậy x : y = 0,4 : 0,3 = 4 : 3
Đáp án B
Câu hỏi 9 :
Cho 200 ml dung dịch X gồm Ba(OH)2 0,5M và NaAlO2 (hay Na[Al(OH)4]) 1,5M. Thêm từ từ dung dịch H2SO4 0,5M vào X cho đến khi kết tủa tan trở lại một phần, thu được kết tủa Y. Đem nung Y đến khối lượng không đổi được 24,32 gam chất rắn Z. Thể tích dung dịch H2SO4 0,5M đã dùng là
- A 0,55 lít.
- B 1,34 lít.
- C 0,67 lít.
- D 1,10 lít.
Đáp án: B
Phương pháp giải:
+ Nếu b/a 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Lời giải chi tiết:
\({n_{O{H^ - }}} = 0,2(mol);\,\,\,\,\,\,{n_{Al{O_2}^ - }} = 0,3(mol);\,\,\,\,\,{n_{B{a^{2 + }}}} = 0,1(mol)\)
\({n_{{H^ + }}} = 2{\rm{x}}(mol) ;\,\,\,\,\,\,\,\,\,{n_{S{O_4}^{2 - }}} = x(mol)\)
Ba2+ + SO42- → BaSO4
OH- + H+ → H2O
AlO2- + H+ + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
Nhận thấy BaSO4 đạt cực đại trước Al(OH)3 (vì khi x = 0,1 mol thì BaSO4 cực đại nhưng Al(OH)3 chưa cực đại)
→ Chất rắn sau nung phải chứa BaSO4 (lượng này cực đại) và Al2O3
Ta có: \({n_{BaS{O_4}}} = {n_{B{a^{2 + }}}} = 0,1(mol)\)
→ \({m_{A{l_2}{O_3}}} = 24,32 - 0,1.233 = 1,02(g) \to {n_{A{l_2}{O_3}}} = \frac{{1,02}}{{102}} = 0,01(mol)\)
→ \({n_{Al{{(OH)}_3}}} = 2{n_{A{l_2}{O_3}}} = 0,02(mol)\)
=> nH+ = nOH- + 4nAlO2 – 3nAl(OH)3 = 1,34 mol
=> Vdd H2SO4 = 1,34 lit
Đáp án B
Câu hỏi 10 :
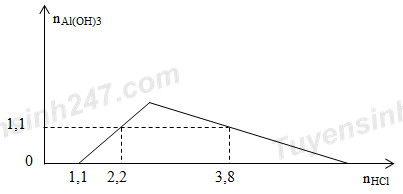
Cho từ từ dung dịch HCl loãng vào dung dịch chứa x mol NaOH và y mol NaAlO2 (hay Na[Al(OH)4]). Sự phụ thuộc của số mol kết tủa thu được vào số mol HCl được biểu diễn theo đồ thị sau:
Giá trị của y là
- A 1,4.
- B 1,8.
- C 1,5.
- D 1,7.
Đáp án: C
Phương pháp giải:
Bài toán đồ thị cho từ từ H+ vào {OH-, AlO2-}
Thứ tự phản ứng khi cho từ từ H+ vào OH-; AlO2- là:
(1) H+ + OH- → H2O
(2) H+ + AlO2- + H2O → Al(OH)3
(3) 3H+ + Al(OH)3 → Al3+ + 3H2O
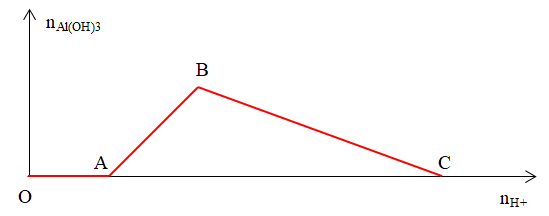
* Đoạn OA ứng với phản ứng (1)
* Đoạn AB ứng với phản ứng (2)
* Đoạn BC ứng với phản ứng (3)
Xét 2 điểm sau:
1. Điểm thuộc đoạn AB: kết tủa chưa đạt cực đại
nH+ = nH+(1) + nH+(2) hay nH+ = nOH- + nAl(OH)3
2. Điểm thuộc đoạn BC: kết tủa tan một phần
nH+ = nH+(1) + nH+(2) max + nH+(3) = nOH- + nAlO2-(bđ) + 3nAl(OH)3 bị tan (*)
Mà bảo toàn Al → nAl(OH)3 bị tan = nAlO2-(bđ) - nAl(OH)3
Thay vào (*) → nH+ = nOH- + 4nAlO2-(bđ) - 3nAl(OH)3
Lời giải chi tiết:
Tại nHCl = 1,1 mol => Trung hòa hết NaOH => x = 1,1 mol
+)Tại nHCl = 2,2 mol => AlO2 dư
+) Tại nHCl = 3,8 mol => Kết tủa tan 1 phần => 3nAl(OH)3 = 4nAlO2 – (nH+ - nOH-)
=> y = 1,5 mol
Đáp án C
Câu hỏi 11 :
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol Ba(OH)2 và b mol Ba(AlO2)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau:
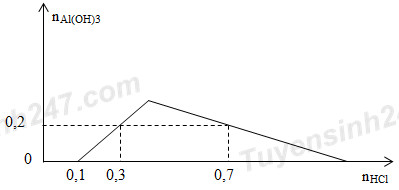
Tỉ lệ a : b là
- A 1 : 3.
- B 1 : 2.
- C 2 : 3.
- D 2 : 1.
Đáp án: A
Phương pháp giải:
+ Nếu b/a 1 thì nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Lời giải chi tiết:
+ Trong khoảng từ 0 – 0,1 thì HCl làm nhiệm vụ trung hòa Ba(OH)2
=> nBa(OH)2 = a = nHCl / 2 = 0,05 mol
+ nHCl = 0,7 mol làm 2 nhiệm vụ: đưa kết tủa cực đại sau đó hòa tan kết tủa
=> nAl(OH)3 = (4.nAlO2- - nHCl phản ứng với AlO2-) / 3 => 3.0,2 = 4.2b – (0,7 – 0,1)
=> b = 0,15 mol
=> a : b = 1 : 3
Đáp án A
Câu hỏi 12 :
Cho từ từ đến dư dung dịch H2SO4 vào dung dịch chứa NaAlO2 và BaCl2. Khối lượng kết tủa (y gam) phụ thuộc vào số mol H2SO4 (x mol) theo đồ thị như hình vẽ. Khối lượng kết tủa cực đại là
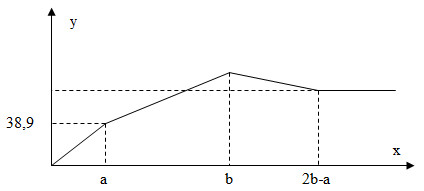
- A 108,8 gam.
- B 73,85 gam.
- C 58,25 gam.
- D 66,05 gam.
Đáp án: D
Phương pháp giải:
Xét 2 trường hợp:
TH1: Tại x = a thì BaSO4 đạt cực đại, Al(OH)3 chưa đạt cực đại
TH2: Tại x = a thì Al(OH)3 đạt cực đại, BaSO4 vẫn chưa đạt cực đại
Công thức tính nhanh:
nH+ = 4nAlO2- – 3nAl(OH)3
Lời giải chi tiết:
Các phản ứng:
Ba2+ + SO42- → BaSO4
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
TH1: Tại x = a thì BaSO4 đạt cực đại, Al(OH)3 chưa đạt cực đại
- Tại nH2SO4 = a (mol) thì BaSO4 đạt cực đại (Ba2+ bị kết tủa hoàn toàn dưới dạng BaSO4)
nBa2+ = nSO42- = nBaSO4 = a (mol) => mBaSO4 = 233a (g)
nH+ = nAl(OH)3 = 2a (mol) => mAl(OH)3 = 156a (g)
=> m ↓ = 233a + 156a = 38,9 => a = 0,1 mol
- Tại nH2SO4 = b (mol) thì Al(OH)3 đạt cực đại (AlO2- chuyển hết thành Al(OH)3)
nH+ = nAlO2- = nAl(OH)3max = 2b (mol)
- Tại nH2SO4 = 2b-a (mol) thì Al(OH)3 vừa bị hòa tan hết thành Al3+
=> nH+ = nAlO2- + 3nAl(OH)3 max = 4nAlO2- => 4b-2a = 4.2b => b < 0 loại
TH2: Tại x = a thì Al(OH)3 đạt cực đại, BaSO4 vẫn chưa đạt cực đại
- Tại nH2SO4 = a (mol) thì Al(OH)3 đạt cực đại, BaSO4 chưa đạt cực đại
nAl(OH)3 = nH+ = 2a mol => nAlO2 max = 2a mol
nBaSO4 = nSO42- = a mol
=> m ↓ = 78.2a + 233a = 38,9 => a = 0,1 mol
- Tại x = 2b – a thì Al(OH)3 bị hòa tan hoàn toàn:
=> nH+ = 4nAlO2- => 4b-2a = 4.2a => b = 0,25 mol
- Tại x = b thì BaSO4 cực đại, khối lượng của kết tủa lớn nhất
nBaSO4 max = nSO42- = b = 0,25 mol
mAl(OH)3 = (4nAlO2- - nH+)/3 = (4.0,2 – 0,5)/3 = 0,1 mol
=> m kết tủa cực đại = 0,25.233 + 0,1.78 = 66,05 gam
Đáp án D
Câu hỏi 13 :
Cho từ từ dung dịch HCl vào dung dịch chứa a mol Ba(AlO2)2 và b mol Ba(OH)2. Số mol Al(OH)3 tạo thành phụ thuộc vào số mol HCl được biểu diễn bằng đồ thị hình dưới đây. Tỉ lệ a : b tương ứng là
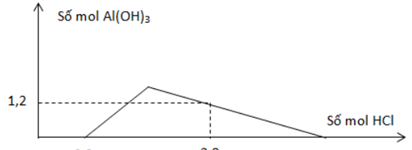
- A 4 : 9.
- B 9 : 4.
- C 7 : 4.
- D 4 : 7.
Đáp án: C
Phương pháp giải:
Nếu cho từ từ H+ đến dư vào dung dịch [Al(OH)4]- thì thứ tự phản ứng như sau:
[Al(OH)4]- + H+ Al(OH)3 + H2O (1)
Al(OH)3 + 3H+ Al3+ + 3H2O (2)
Lời giải chi tiết:
- Tại nHCl = 0,8 => phản ứng trung hòa hoàn toàn => nOH = nHCl = 0,8 mol
=> nBa(OH)2 = b = ½.0,8 = 0,4 mol
- Tại nHCl = 2,8 mol => kết tủa bị hòa tan 1 phần
=> 3nAl(OH)3 = 4nAlO2 – (nH+ - nOH-)
=> 3.1,2 = 4.2a – (2,8 – 0,8)
=> a = 0,7 mol
=> a : b = 0,7 : 0,4 = 7 : 4
Đáp án C
Câu hỏi 14 :
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol NaOH và b mol NaAlO2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
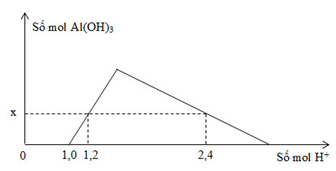
Tổng giá trị (a + b) là
- A 0,5.
- B 1,5.
- C 0,7.
- D 1,7.
Đáp án: B
Phương pháp giải:
Nếu cho H+ tác dụng với dung dịch [Al(OH)4]- thì xảy ra 1 hoặc 2 phản ứng sau:
[Al(OH)4]- + H+→ Al(OH)3 + H2O (1)
Al(OH)3 + 3H+→ Al3+ + 3H2O (2)
*Phương pháp: Nếu đặt: n[Al(OH)4]- = a mol; nH+ = b mol thì:
+ Nếu b/a 1 thì: nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và: nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Lời giải chi tiết:
Thứ tự phản ứng: H+ + OH- → H2O
H+ + AlO2- + H2O → Al(OH)3
3H+ + Al(OH)3 → Al3+ + 3H2O
- Tại: nH+ = 1,0 mol => bắt đầu có kết tủa => Phản ứng trung hòa hoàn toàn => nOH = 1 mol = a
- Tại nH+ = 1,2 mol => chưa có hiện tượng hòa tan kết tủa => nAl(OH)3 = nH+ pứ = 1,2 – 1 = 0,2 mol
- Tại nH+ = 2,4 mol => có hiện tượng hòa tan 1 phần kết tủa => nAl(OH)3 = 1/3.(4nAlO2 – nH+ pứ)
=> 0,2 = 1/3.[4b – (2,4 – 1,0)] => b = 0,5 mol
=> (a + b) = 1,5 mol
Đáp án B
Câu hỏi 15 :
Cho từ từ dung dịch HCl (loãng) vào dung dịch chứa đồng thời x mol NaOH và y mol NaAlO2, từ kết quả thí nghiệm vẽ được đồ thị như sau:
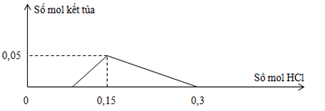
Giá trị của (x – y) là:
- A 0,25
- B 0,05
- C 0,15
- D 0,10
Đáp án: B
Phương pháp giải:
Nếu cho H+ tác dụng với dung dịch [Al(OH)4]- thì xảy ra 1 hoặc 2 phản ứng sau:
[Al(OH)4]- + H+→ Al(OH)3 + H2O (1)
Al(OH)3 + 3H+→ Al3+ + 3H2O (2)
*Phương pháp: Nếu đặt: n[Al(OH)4]- = a mol; nH+ = b mol thì:
+ Nếu b/a 1 thì: nAl(OH)3 = b
+ Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và: nAl(OH)3 = (4a – b)/3
+ Nếu b/a 4 thì không có kết tủa
Lời giải chi tiết:
Thứ tự các phản ứng:
(1) H+ + OH- → H2O
(2) H+ + AlO2- + H2O → Al(OH)3
(3) 3H+ + Al(OH)3 → Al3+ + 3H2O
Dựa vào đồ thị ta thấy:
- Tại nHCl = 0,15 mol thì kết tủa đạt max => nHCl = nOH- + nAlO2- = 0,15 mol
Và nAl(OH)3 = nAlO2- = y = 0,05 mol => nOH = x = 0,15 – 0,05 = 0,1 mol
=> (x – y) = 0,1 – 0,05 = 0,05 mol
Đáp án B
Câu hỏi 16 :
Nhỏ từ từ đến dư dung dịch H2SO4 vào dung dịch chứa đồng thời NaAlO2;Ba(AlO2)2; Ba(OH)2. Sự phụ thuộc của khối lượng kết tủa (y gam) vào số mol H2SO4 tham gia phản ứng (x mol) được biểu diễn bằng đồ thị sau:
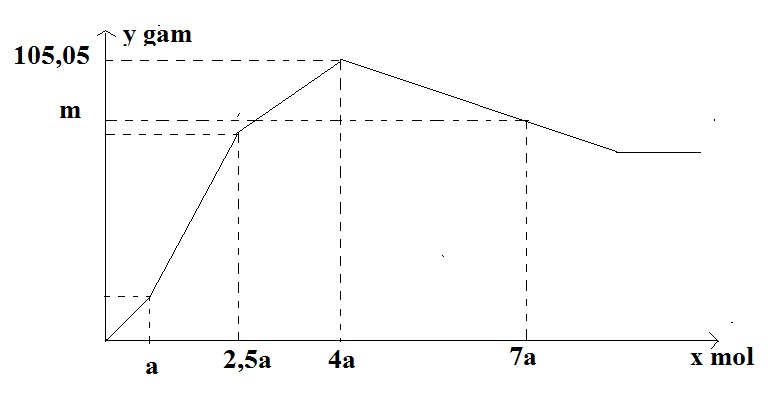
Giá trị của m là
- A 89,45
- B 77,7
- C 93,35
- D 81,65
Đáp án: A
Phương pháp giải:
Thứ tự PTHH xảy ra là Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Ba(AlO2)2 + H2SO4 + 2H2O → BaSO4 + 2Al(OH)3
2NaAlO2 + H2SO4 + 2H2O → Na2SO4 + 2Al(OH)3
Tại thời điểm kết tủa max thì →phương trình của a → a
Tại thời điểm 7a mol H2SO4 thì nH2SO4 = ? mol
So với thời điểm kết tủa max thì nH2SO4 (thêm) = ? mol
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 3H2O
→ mkết tủa = mkết tủa max – mAl(OH)3 hòa tan thêm
Lời giải chi tiết:
Thứ tự PTHH xảy ra là Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
a a a
Ba(AlO2)2 + H2SO4 + 2H2O → BaSO4 + 2Al(OH)3
1,5a 1,5a 3a
2NaAlO2 + H2SO4 + 2H2O → Na2SO4 + 2Al(OH)3
1,5a 3a
Tại thời điểm kết tủa max có mkết tủa = mBaSO4 + mAl(OH)3 = (a + 1,5a).233 + 78.(3a + 3a) → a = 0,1 mol
Tại thời điểm 7a mol H2SO4 thì nH2SO4 = 0,7 mol
So với thời điểm kết tủa max thì nH2SO4 (thêm) = 0,3 mol
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 3H2O
0,2 ← 0,3
→ mkết tủa = mkết tủa max – mAl(OH)3 hòa tan thêm = 105,05 – 0,2.78 = 89,45
Đáp án A
Câu hỏi 17 :
Thực hiện phản ứng nhiệt nhôm hỗn hợp Al và Fe2O3 (trong điều kiện không có không khí) thu được 36,15g hỗn hợp X. Nghiền nhỏ, trộn đều và chia thành 2 phần:
- Cho phần 1 tác dụng với dung dịch NaOH dư thu được 1,68 lít khí H2(đktc) và 5,6g chất rắn không tan.
- Hòa tan hết phần 2 trong 850 ml dung dịch HNO3 2M thu được 3,36 lít khí NO và dung dịch chỉ chứa m gam hỗn hợp muối. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị nào sau đây:
- A 103
- B 95
- C 113
- D 110
Đáp án: C
Phương pháp giải:
Bài toán hỗn hợp kim loại, oxit tan hết trong HNO3
- Quy hỗn hợp về dạng: KL, O
=> Công thức giải nhanh:
ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 + 2nO
nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 + 2nO
Lời giải chi tiết:
- Phần 1:
nH2 = 1,68: 22,4 = 0,075 mol
Khi cho hỗn hợp + NaOH tạo khí => Al dư => ở phản ứng nhiệt nhôm, Fe2O3 hết
=> chất rắn sau phản ứng với NaOH là Fe
Al + NaOH + H2O → NaAlO2 + 1,5H2
=> nAl = 2/3 nH2 = 0,05 mol ; nFe = 0,1 mol
2Al + Fe2O3 → Al2O3 + 2Fe
Mol 0,1 0,05 0,05 0,1
m1 = (0,1 + 0,05).27 + 0,05.160 = 12,05g
=> m1: mhh = 12,05: 36,15 = 1: 3
=> khối lượng của phần 2 gấp đôi phần 1
- Phần 2: Từ số mol phần 1 => Quy hỗn hợp thành: 0,3 mol Al ; 0,2 mol Fe ; 0,3 mol O
nHNO3 = 0,85.2 = 1,7 mol ; nNO = 3,36: 22,4 = 0,15 mol
Ta có: nHNO3 = 4nNO + 2nO + 10nNH4NO3
=> nNH4NO3 = 0,05 mol
Bảo toàn nguyên tố H: nHNO3 = 4nNH4NO3 + 2nH2O
=> nH2O = 0,75 mol
Bảo toàn khối lượng: m2 + mHNO3 = mmuối + mNO + mH2O
=> mmuối = 2.12,05 + 1,7.63 – 0,15.30 – 0,75.18 = 113,2g
Đáp án C
Câu hỏi 18 :
Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và Fe2O3 (trong điều kiện không có không khí) thu được 36,15 gam hỗn hợp X. Nghiền nhỏ, trộn đều và chia thành 2 phần:
- Phần 1: tác dụng với dung dịch NaOH dư thu được 1,68 lít H2 (đktc) và 5,6 gam chất rắn không tan.
- Phần 2: Hòa tan hết trong 850 ml dung dịch HNO3 2M thu được 3,36 lít NO và dung dịch chỉ chứa m gam hỗn hợp muối. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với giá trị:
- A 95.
- B 103.
- C 110.
- D 113.
Đáp án: D
Câu hỏi 19 :
Tiến hành phản ứng nhiệt nhôm hỗn hợp X gồm 0,03 mol Cr2O3; 0,04 mol FeO và a mol Al. Sau một thời gian phản ứng, trộn đều thu dược hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một phản ứng vừa đủ với 400 ml dung dịch NaOH 0,1M (loãng). Phần hai phản ứng với dung dịch HCl loãng, nóng (dư), thu được 1,12 lít khí H2 (đktc). Giả sử trong phản ứng nhiệt nhôm, Cr2O3 chỉ bị khử thành Cr. Phần trăm khối lượng Cr2O3 đã phản ứng là
- A 33,33%.
- B 50,00%.
- C 20,00%.
- D 66,67%.
Đáp án: D
Phương pháp giải:
- Sau phản ứng chia làm hai phần bằng nhau, vậy mỗi phần tương đương với lượng phản ứng ban đầu là 0,015 mol Cr2O3, 0,02 mol FeO và a/2 = b mol Al. Số mol các chất trong mỗi phần của hỗn hợp Y là như nhau. (Al, Al2O3, Cr, Cr2O3, Fe, FeO).
- Các chất phản ứng với dd NaOH loãng là Al, Al2O3. Riêng Cr2O3 chỉ phản ứng với dd NaOH đặc
- Các chất phản ứng với dd HCl loãng nóng, tạo H2 là Al, Cr, Fe.
- Vậy xét P1: Al + NaOH và Al2O3 + 2NaOH
x x y 2y
=> Số mol Al ban đầu = x + 2y = nNaOH = 0,04 mol
- Xét các phản ứng nhiệt nhôm
2Al + Cr2O3 → Al2O3 + 2Cr
2Al + 3FeO → Al2O3 + 3Fe
- Xét phản ứng với dd HCl, ta có tỉ lệ
Al → 1,5H2 ; Cr→ H2; Fe → H2
Tính toán theo các phương trình hóa học trên để tính hiệu suất phản ứng.
Lời giải chi tiết:
- Sau phản ứng chia làm hai phần bằng nhau, vậy mỗi phần tương đương với lượng phản ứng ban đầu là 0,015 mol Cr2O3, 0,02 mol FeO và b mol Al (với b = a/2). Số mol các chất trong mỗi phần của hỗn hợp Y là như nhau. (Al, Al2O3, Cr, Cr2O3, Fe, FeO).
Chú ý: Nhiều HS giải cho rằng FeO phản ứng hết. Điều này có thể không chính xác và không khẳng định được.
- Các chất phản ứng với dd NaOH loãng là Al, Al2O3. Riêng Cr2O3 chỉ phản ứng với dd NaOH đặc
- Các chất phản ứng với dd HCl loãng nóng, tạo H2 là Al, Cr, Fe.
- Vậy xét P1: Al + NaOH và Al2O3 + 2NaOH
x x y 2y
=> Số mol Al ban đầu = x + 2y = nNaOH = 0,04 mol
- Xét các phản ứng nhiệt nhôm
2Al + Cr2O3 → Al2O3 + 2Cr
m m/2 m
2Al + 3FeO → Al2O3 + 3Fe
n 1,5n
- Xét phản ứng với dd HCl, ta có tỉ lệ
Al → 1,5H2 ; Cr → H2; Fe → H2
=> nH2 = 1,5x + m + 1,5n và x = 0,04 – m – n
=> 1,5 (0,04 – m – n) + m + 1,5n = 0,05 => 0,06 - 1,5m - 1,5n + m + 1,5n = 0,05
=> 0,06 – 0,5m = 0,05 => m = 0,02
=> Số mol Cr2O3 phản ứng = m/2 = 0,01 mol
=> h = 0,01/0,015*100% = 66,67%.
- Đến đây ta thấy rằng lượng FeO phản ứng không ảnh hưởng tới kết quả phản ứng của Cr2O3.
Gọi x là % Cr2O3 đã phản ứng
0,5a = 0,04
0,5a*3 - 0,015x*2 = 0,05*2
=>a = 0,08 và x = 0,6667
Hoặc: (0,04*3-0,05*2):2*100:0,015 = 66,667%
Đáp án D
Câu hỏi 20 :
Thực hiện phản ứng nhiệt nhôm hỗn hợp gồm Al và m gam hai oxit sắt trong khí trơ, thu được hỗn hợp chất rắn X. Cho X vào dung dịch NaOH dư, thu được dung dịch Y, chất không tan Z và 0,672 lít khí H2 (đktc). Sục khí CO2 dư vào Y, thu được 8,58 gam kết tủa. Cho Z tan hết vào dung dịch H2SO4 (đặc, nóng), thu được dung dịch chứa 20,76 gam muối sunfat và 3,472 lít khí SO2 (đktc). Biết SO2 là sản phẩm khử duy nhất của S+6, các phản ứng xảy ra hoàn toàn. Giá trị của m là
- A 8,04.
- B 7,28.
- C 6,96.
- D 6,80.
Đáp án: A
Phương pháp giải:
Do cho X vào NaOH dư thu được khí H2 nên trong phản ứng nhiệt nhôm Al dư, oxit sắt phản ứng hết.
X gồm Al dư, Fe, Al2O3.
- Cho X phản ứng với NaOH dư: Từ số mol H2 suy ra số mol của Al
- Sục CO2 dư vào Y tính được nAl(OH)3
BTNT “Al” tính được số mol của Al2O3 => nO (oxit)
- Xét phản ứng của Z (Fe) với H2SO4 đặc nóng:
Đặt nFeSO4 = x và nFe2(SO4)3 = y (mol)
m muối => (*)
BTe: 2nFe2+ + 3nFe3+ = 2nSO2 => (**)
Giải hệ (*) và (**) được x, y => nFe(oxit)
Tính được m = mFe(oxit) + mO(oxit)
Lời giải chi tiết:
Do cho X vào NaOH dư thu được khí H2 nên trong phản ứng nhiệt nhôm Al dư, oxit sắt phản ứng hết.
X gồm Al dư, Fe, Al2O3.
- Cho X phản ứng với NaOH dư: nH2 = 0,03 mol;
(1) Al + NaOH + H2O → NaAlO2 + 1,5H2
0,02 ← 0,02 ← 0,03
(2) Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Sục CO2 dư vào Y: nAl(OH)3 = 8,58 : 78 = 0,11 mol
(3) NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3
0,11 ← 0,11
=> nNaAlO2(2) = nNaAlO2(3) – nNaAlO2(1) = 0,11 – 0,02 = 0,09 => nAl2O3 = 0,09:2 = 0,045 mol
BTNT “O”: nO(oxit) = 3nAl2O3 = 3.0,045 = 0,135 mol
- Xét phản ứng của Z (Fe) với H2SO4 đặc nóng:
Đặt nFeSO4 = x và nFe2(SO4)3 = y (mol)
m muối = 152x + 400y = 20,76 (*)
BTe: 2nFe2+ + 3nFe3+ = 2nSO2 => 2x + 3.2y = 2.0,155 (**)
Giải hệ (*) và (**) được x = 0,005 và y = 0,05
=> nFe(oxit) = 0,005 + 0,05.2 = 0,105 mol
Vậy m = mFe(oxit) + mO(oxit) = 0,105.56 + 0,135.16 = 8,04 gam
Đáp án A
