Như chúng ta đều biết, hóa học là một môn học rất quan trọng. Đặc biệt là đối với các bạn theo khoa học tự nhiên. Để có thể học tốt bộ môn Hóa học, việc nắm vững các nguyên tố, ký hiệu hóa học, hóa trị, vị trí của các nguyên tố trên bảng tuần hoàn là điều quan trọng trước nhất. Do đó, lượng kiến thức mà bảng tuần hoàn hóa học mang lại là cực kỳ lớn mà chúng ta không thể bỏ qua.
Nếu các bạn đang tìm kiếm một bảng tuần hoàn hóa học chuẩn nhất để phục vụ cho quá trình học tập. Và nâng cao kiến thức môn Hóa học của mình thì hãy tham khảo bài viết dưới đây của chúng tôi nhé!
Mục lục [Hiển thị]
Bảng tuần hoàn hóa học là gì?
Bảng tuần hoàn hóa học có tên gọi đầy đủ là bảng tuần hoàn các nguyên tố hóa học. Bảng tuần hoàn Mendeleev. Là một phương pháp liệt kê các nguyên tố hóa học thành bảng dựa trên số hiệu nguyên tử (số proton trong hạt nhân). Cấu hình electron và các tính chất hóa học tuần hoàn của chúng.
Bảng tuần hoàn hóa học được công bố chính thức rộng rãi vào năm 1869. Và trở thành tài liệu quan trọng cho các công trình nghiên cứu với nhiều thành tựu lớn. Sự ra đời của bảng tuần hoàn hóa học có ý nghĩa vô cùng quan trọng đối với sự phát triển của nhân loại. Nó giúp con người hiểu được các định luật vận hành của thế giới. Ứng dụng vào nhiều lĩnh vực , tạo tiền đề cho sự phát triển của lĩnh vực nguyên tử sau này.
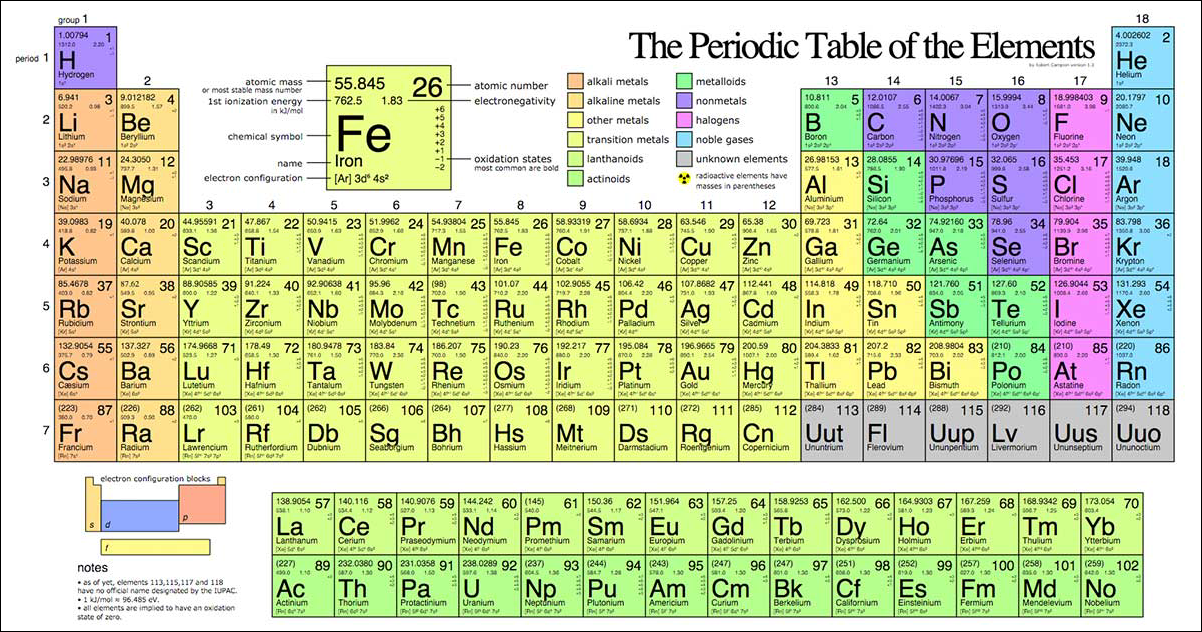
Trong bảng tuần hoàn hóa học, các nguyên tố sẽ được sắp xếp theo thứ tự số hiệu nguyên tử tăng dần. Và ký hiệu hóa học của từng nguyên tố trong mỗi ô. Một bảng tuần hoàn hóa học chuẩn sẽ bao gồm 18 cột và 7 dòng với 2 dòng kép nằm riêng bên dưới.
Bố cục chuẩn của bảng tuần hoàn hóa học
Bố cục dạng chuẩn của bảng tuần hoàn hóa học bao gồm 18 cột và 7 hàng với 2 dòng kép nằm riêng bên dưới là họ Lantan và họ Actini.
Cùng với việc công nhận nguyên tố 113 là nguyên tố hóa học. IUPAC cũng đã chính thức đưa 3 nguyên tố khác với số hiệu nguyên tử lần lượt là 115, 117 và 118 vào bảng tuần hoàn hóa học. Có thể nói, đây là một bản cập nhật lớn của bảng tuần hoàn tính từ năm 2011. Khi mà nguyên tố 114 và 116 cũng đã được đưa vào. Chính vì vậy, giờ đây, chu kỳ 7 đã được lấp đầy.
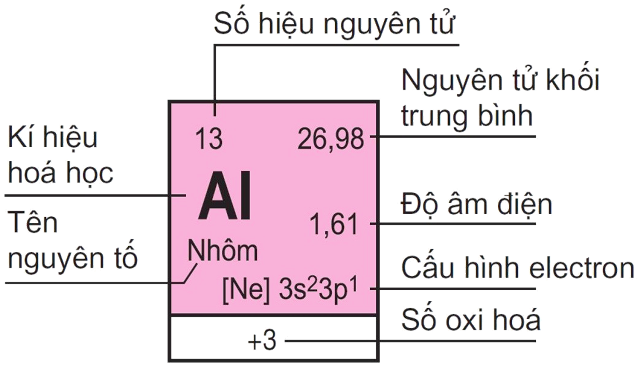
Trong đó ý nghĩa như sau:
Phương pháp sắp xếp của bảng tuần hoàn hóa học
1. Sắp xếp các nguyên tố dựa vào nhóm
Nhóm (hay còn gọi là họ) là một cột đứng trong bảng tuần hoàn. Đặc điểm của nhóm là thể hiện nhiều xu hướng tuần hoàn quan trọng hơn là các chu kỳ và các khối.
Các nguyên tố thuộc cùng một nhóm sẽ có cấu hình electron như nhau trong lớp hóa trị của chúng. Do đó, tính chất hóa học của các nguyên tố này sẽ giống nhau. Thể hiện một xu hưởng rõ ràng trong các tính chất với số hiệu nguyên tử tăng dần. Mặc dù vậy, trong một số phần của bảng tuần hoàn. Tính tương đồng theo chiều ngang cũng giữ một vai trò quan trọng. Thậm chí là quan trọng hơn so với tính tương đồng theo chiều dọc.
Các nguyên tố trong cùng một nhóm. Xét từ trên xuống dưới, bán kính nguyên tử sẽ tăng dần. Vì thế, mức năng lượng được lấp đầy hơn. Các electron hóa trị cũng xuất hiện ở xa hạt nhân hơn.
Đồng thời, từ trên xuống, các nguyên tố sau sẽ có mức năng lượng ion hóa thấp hơn. Tức là sẽ dễ tách electron ra khỏi nguyên tử bỏ liên kết lỏng lẻo đi. Và cũng tương tự, độ âm điện của các nguyên tố trong cùng một nhóm sẽ giảm xuống. Do khoảng cách giữa các electron hóa trị và hạt nhân tăng dần. Tuy nhiên, xu hướng này sẽ không chính xác với nhóm 11 có độ âm điện tăng từ trên xuống dưới.
2. Sắp xếp các nguyên tố dựa vào chu kỳ
Chu kỳ ở đây chính là các hàng ngang trong bảng tuần hoàn hóa học, một chu kỳ là một hàng ngang.
Thông thường, các nhóm sẽ có xu hướng quan trọng hơn. Nhưng có những vùng trong bảng tuần hoàn hóa học mà xu hướng theo chiều ngang quan trọng hơn chiều dọc. Ví dụ như ở khối F, với các họ Lantan và họ Actini sẽ tạo nên 2 chuỗi hàng ngang quan trọng.
Đồng thời, trong một chu kỳ tính theo chiều từ trái sang phải. Bán kính nguyên tử của các nguyên tố sẽ giảm dần. Bởi mỗi nguyên tố thêm vào proton sẽ khiến cho electron lớp ngoài bị kéo lại gần hạt nhân hơn. Khi bán kính nguyên tử giảm sẽ làm cho năng lượng ion hóa và độ âm điện tăng dần.
3. Sắp xếp các nguyên tố dựa vào khối
Các nguyên tố trong bảng tuần hoàn hóa học thuộc 4 khối: khối s, khối p, khối d và khối f. Electron cuối cùng điền vào phân lớp nào (theo thứ tự mức năng lượng) thì nguyên tố thuộc khối đó.
- Khối s sẽ bao gồm hai nhóm đầu tiên là IA và IIA (kim loại kiềm và kiềm thổ) cũng như Hidro và Heli.
- Khối p bao gồm 6 nhóm cuối từ nhóm 13 đến nhóm 18 theo IUPAC, trong đó có tất cả các á kim và một số kim loại, phi kim.
- Khối d bao gồm các nhóm từ 3 đến 12 theo IUPAC và chứa tất cả kim loại chuyển tiếp.
- Khối f thường xếp riêng bên dưới của bảng tuần hoàn hóa học bao gồm những nguyên tố kim loại thuộc các họ Lantan và Actini.
4. Một số quy ước sắp xếp khác
Theo tính chất, các nguyên tố trong bảng tuần hoàn hóa học có thể chia làm các loại chính là: kim loại, phi kim và á kim.
Trong một bảng tuần hoàn, kim loại sẽ thường được phân bố ở bên trái và phía dưới. Kim loại là những chất rắn có ánh kim, dẫn điện và dẫn nhiệt tốt. Có thể tạo thành hợp kim với nhau và hợp chất với phi kim.
Phi kim thường nằm ở phía bên phải và phía trên của bảng tuần hoàn hóa học. Là các khí có màu hoặc không có màu, cách điện và cách nhiệt. Hình thành nên hợp chất hóa trị với nhau. Còn ở giữa kim loại và phi kim chính là á kim. Có tính chất trung gian hoặc kết hợp giữa kim loại và phi kim. Các nguyên tố sẽ giảm tính kim loại và tăng tính phi kim từ trái sang phải.
Xét cụ thể, kim loại được chia thành: kim loại kiềm hoạt động mạnh. Kim loại kiềm thổ ít hoạt động hơn, họ Lantan và Actini. Kim loại chuyển tiếp nguyên hình (gồm cả kim loại chịu nhiệt, kim loại hiếm) và kim loại yếu hơn về hóa học lẫn vật lý.
Còn phi kim cũng được chia thành: phi kim đa nguyên tử nằm gần á kim nhất thể hiện chút ít đặc tính kim loại; phi kim 2 nguyên tử thể hiện tính phi kim rõ ràng; phi kim đơn nguyên tử (khí hiếm) gần như hoàn toàn trơ và phi kim.
Bố cục của bảng tuần hoàn hóa học được quy ước là họ Lantan và họ Actini. Thể hiện thành 2 hàng dưới cùng của bảng tuần hoàn. Tuy nhiên, cũng có nhiều loại bảng rộng có chèn các họ nguyên tố này vào vị trí chính xác của chúng (một phân ở chu kỳ 6, chu kỳ 7).
Tổng kết
Như vậy, trong bài viết này đã giới thiệu về bảng tuần hoàn hóa học với các nguyên tố hóa học. Bố cục của bảng tuần hoàn cũng như các phương pháp sắp xếp bảng tuần hoàn. Hy vọng rằng những thông tin này sẽ giúp ích cho các bạn trong quá trình học tập cũng như nghiên cứu bộ môn Hóa học. Chúc các bạn thành công!